
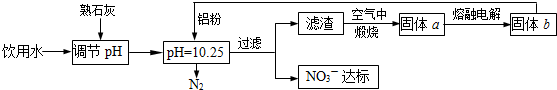
(1)饮用水中的NO![]() 对人类健康会产生危害,为了降低饮用水中NO
对人类健康会产生危害,为了降低饮用水中NO![]() 的浓度,可以在碱性条件下用铝粉将NO
的浓度,可以在碱性条件下用铝粉将NO![]() 还原为N2,其化学方程式为:
还原为N2,其化学方程式为:
10Al+2NaNO3+4NaOH===10NaAlO2+3N2↑+2H2O。请回答下列问题:
①上述反应中,________元素的化合价升高,则该元素的原子________(填“得到”或“失去”)电子。
②用“单线桥法”表示反应中电子转移的方向和数目:
10Al+6NaNO3+4NaOH===10NaAlO2+3N2↑+2H2O
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
| O | - 3 |
| O | - 3 |
| O | - 3 |
| O | - 3 |
| O | - 3 |
| O | - 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
- 3 |
- 3 |
- 3 |
- 3 |
- 3 |
+ 4 |
+ 4 |
- 3 |
+ 4 |
- 3 |
查看答案和解析>>
科目:高中化学 来源:江西省会昌中学2010-2011学年高一第一次月考化学试题 题型:022
饮用水中的NO![]() 对人类健康会产生危害,为了降低饮用水中NO
对人类健康会产生危害,为了降低饮用水中NO![]() 的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO
的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO![]() 还原为N2,其化学方程式为:10AL+6NaNO3+4NaOH
还原为N2,其化学方程式为:10AL+6NaNO3+4NaOH![]() 10NaALO2+3N2+2H2O↑.请回答下列问题:
10NaALO2+3N2+2H2O↑.请回答下列问题:
(1)上述反应中,________元素的化合价升高,则该元素的原子________(填“得到”或“失去”)电子;而________元素的化合价降低,则该元素的原子被________(填“氧化”或“还原”).
(2)上述反应中,若有10个铝原子参与反应,则转移的电子总数为________,用“双线桥法”表示反应中电子转移的方向和数目:
10Al+6NaNO3+4NaOH![]() 10NaAlO2+3N2+2H2O↑
10NaAlO2+3N2+2H2O↑
查看答案和解析>>
科目:高中化学 来源:湖北省荆州中学2010-2011学年高一上学期期末考试化学试题 题型:022
关注饮用水,保证人民的生活质量.回答下列两个问题:
(1)饮用水中的NO![]() 对人类健康会产生危害,为了降低饮用水中NO
对人类健康会产生危害,为了降低饮用水中NO![]() 的浓度,可以在碱性条件下用铝粉将NO
的浓度,可以在碱性条件下用铝粉将NO![]() 还原为N2,其化学方程式为:
还原为N2,其化学方程式为:
10Al+6NaNO3+4NaOH 10NaAlO2+3N2↑+2H2O
10NaAlO2+3N2↑+2H2O
①上述反应中的氧化产物为________.
②上述反应中若生成标况下11.2 L
N2,则转移的电子的物质的量为________mol.(2)洪灾过后,饮用水的
消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一.漂白粉是常用的消毒剂.①
工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为________.②漂白粉的有效成分是(填化学式)________.
③漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,离子方程式为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com