
【题目】如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法错误的是
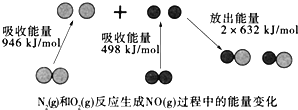
A. 该反应的热化学方程式为:N2(g)+O2(g)═2NO(g)△H=+180kJ·mol﹣1
B. 1mol N2(l)和NA个O2(l)反应生成2mol NO(g)时,吸收的能量为180kJ
C. 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量
D. 通常情况下,N2(g)和O2(g)混合不能直接生成NO(g)
【答案】B
【解析】
A、△H=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,则反应N2(g)+O2(g)=2NO(g)的反应热△H=946kJ/mol+498kJ/mol-2×632kJ/mol=+180kJ/mol,A正确;
B、由A可知,应该是1mol N2(g)和NA个O2(g)反应生成2mol NO(g)时,吸收的能量为180kJ,B错误;
C、N2(g)+O2(g)=2NO(g)△H=+180kJ/mol,为吸热反应,所以1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量,C正确;
D、通常情况下,N2(g)和O2(g)不能发生化学反应,一般需要高温或放电,D正确;
答案选B。
本题考查了反应能量变化的计算和判断,反应的焓变计算方法和能量守恒是解题的关键。注意反应热与键能以及物质总能量的关系。


科目:高中化学 来源: 题型:
【题目】现有A.纯碱 B二氧化硅 C二氧化硫 D 熟石灰 E 三氧化二铁.
请你根据已有的知识,选择合适的物质,用字母代号填空:
(1)能形成酸雨的是__________;
(2)光纤制品的成分是__________;
(3)属于碱的是__________;
(4)红棕色固体是__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学装置的说法正确的是 ( )


A. 用图1装置处理银器表面的黑斑(Ag2S),银器表面发生的反应为Ag2S+2e-=2Ag+S2-
B. 用图2装置电解一段时间后,铜电极部分溶解,溶液中铜离子的浓度基本不变
C. 图3装置中若直流电源的X极为负极,则该装置可实现粗铜的电解精炼
D. 图4装置中若M是铜,则该装置能防止铁被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaOH固体配制一定物质的量浓度的溶液,下列操作中正确的是( )
A. 称量时,应先在两盘上放等质量的纸,再将固体NaOH放在天平左盘上称量
B. 将称量好的固体NaOH放入容量瓶中,加蒸馏水溶解
C. 将烧杯中溶解固体NaOH所得溶液,冷却到室温后转移至容量瓶中
D. 定容时如果加水超过了刻度线,用胶头滴管再吸出多余部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g) △H=xkJ·mol-l
已知:①C(s)+O2(g)=CO2(g) △H=akJ·mol-l
②K2S(s)=S(s)+2K(s) △H=bkJ·mol-l
③2K(s)+N2(g)+3O2(g)=2KNO3(s) △H=ckJ·mol-l
下列说法正确的是
A. x>0 a<0
B. b<0 c<0
C. x=3a-b-c
D. 1mol 碳(s)在空气中不完全燃烧生成CO的焓变小于akJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,充入气体X和气体Y反应生成气体Z,从反应开始到建立化学平衡,用X、Y、Z分别表示的化学反应速率为v(X)、v(Y)、v(Z)有以下关系:v(X)=3v(Y)、2v(Y)=v(Z),则此反应的化学方程式是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
①1 L 0.1 mol·![]() NH4Cl溶液中,
NH4Cl溶液中,![]() 的数量为0.1 NA
的数量为0.1 NA
②0.1 mol H2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2 NA
③标准状况下,22.4 L二氯甲烷的共价键数为7NA个
④一定条件下,2 mol SO2和1 mol O2混合在密闭容器中充分反应后容器中的分子数大于2 NA
⑤31g白磷P4中含P—P单键数目为6NA
⑥2 mL 0.5 mol/L FeCl3溶液滴入沸水中制备Fe(OH)3胶体,所得胶粒数目小于0.001 NA
A. ①④⑥ B. ②④⑥ C. ②④⑤ D. ②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
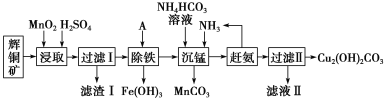
(1)“浸取”反应中氧化剂的化学式为________;若“浸取”反应中得到一种单质,则滤渣Ⅰ的成分为 MnO2 和________、________ (写化学式)。
(2)“除铁”这一步反应在 25 ℃ 进行,加入的试剂 A 为________,若加 A 后溶液 的 pH调为 4,溶液中 Fe3+浓度为______mol/L。{已知 Ksp[Fe(OH)3]=4.0×10-38}
(3)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:________________________________。
(4)滤液Ⅱ经蒸发结晶得到的盐主要是__________(写化学式)。
(5)过滤Ⅱ的沉淀经过洗涤、干燥可以得到碱式碳酸铜,如何判断沉淀已洗净?_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为:
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,
2NH3(g) ΔH=-92.4 kJ·mol-1,
I. 该反应 N2(g)+3H2(g)![]() 2NH3(g)△H=﹣92.4kJ/mol 在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。
2NH3(g)△H=﹣92.4kJ/mol 在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。

(1)t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1___________,t3____________,t4__________。
(2)下列时间段中,氨的百分含量最高的是__________
A.0~t1 B.t2~t3
C.t3~t4 D.t4~t5
II. 在密闭容器中,投入1mol N2和3 mol H2在催化剂作用下发生反应:
(1)当反应达到平衡时,N2和H2的浓度比是___________;N2和H2的转化率比是___________。
(2)缩小体积增大压强,混合气体的平均相对分子质量________ (填“变大”、“变小”或“不变”)。
(3)当达到平衡时,充入氩气,并保持总压强不变,平衡将___________(填“正向”、“逆向”或“不移动”)。
(4)已知合成氨的反应在298K时:正反应的△H=-92.4kJ/mol,△S=-0.1982kJ/(mol·K),根据焓变和熵变判断298K下合成氨反应________(填“能”或“不能”)自发进行。
(5)若容器恒容、绝热,该反应达到平衡的标志是___________
①反应速率v(N2):v(H2):v(NH3)=1:3:2
②各组分的物质的量浓度不再改变
③体系的压强不再发生变化
④混合气体的密度不变
⑤体系的温度不再发生变化
⑥2V正(N2) =V正(NH3)
⑦单位时间内3mol H-H断裂同时2mol N-H也断裂.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com