
【题目】改变0.1molL—1二元弱酸H2A溶液的pH,溶液中的H2A、HA—、A2—的物质的量分数δ(x)随pH的变化如图所示[已知δ(x)=c(x)/[c(H2A)+c(HA—)+c(A2—)]。下列叙述错误的是
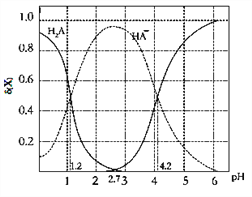
A. 向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离程度一直增大
B. K2(H2A)=10﹣4.2
C. pH=2.7时,[c(HA—)]2/[c(H2A)c(A2—)]=100
D. pH=4.2时,c(HA﹣) =c (A2—)且c(H2A)≈0
【答案】C
【解析】A.向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离程度一直增大,选项A正确;B.pH=4.2时,c(H+)=10-4.2mol/L,c(HA-)=c(A2-),K2(H2A)=![]() =10-4.2,选项B正确;C.由图象可知,pH=1.2时,c(H2A)=c(HA-),Ka1= c(H+)=10-1.2,pH=2.7时,c(H2A)=c(A2-),[c(HA—)]2/[c(H2A)c(A2—)]= [c(HA—)]2/[c(H2A)]2=
=10-4.2,选项B正确;C.由图象可知,pH=1.2时,c(H2A)=c(HA-),Ka1= c(H+)=10-1.2,pH=2.7时,c(H2A)=c(A2-),[c(HA—)]2/[c(H2A)c(A2—)]= [c(HA—)]2/[c(H2A)]2=![]() =
=![]() =10-23.6,选项C错误;D.pH=4.2时,c(HA-)=c(A2-),此时c(H2A)≈0,选项D正确。答案选C。
=10-23.6,选项C错误;D.pH=4.2时,c(HA-)=c(A2-),此时c(H2A)≈0,选项D正确。答案选C。


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】回答下列各题:
(1)相同质量的O2和O3所含氧原子的个数比为______,标准状况下气体的体积之比为_______;
某19g二价金属氯化物(ACl2)中含有0.4mol Cl-,则ACl2的摩尔质量是_______。
(2)某反应中反应物与生成物有:NH3、H2SO4、KClO3、K2SO4、HNO3、H2O和一种未知物质X。
①已知 KClO3在反应中得到电子,则该反应的还原剂是____。
②已知 0.2mol KClO3在反应中得到1mol电子生成X,则X的化学式为____。
③根据上述反应可推知还原性: NH3____X (填>、<符号)。
(3)已知反应:
①SO3+H2O=H2SO4 ②Cl2+H2O=HCl+HClO ③2F2+H2O=4HF+O2
④2Na+2H2O=2NaOH+H2↑ ⑤Na2O+H2O=2NaOH ⑥Fe2O3+3H2![]() 2Fe+3H2O
2Fe+3H2O
上述反应中,不属于氧化还原反应的有_________(填序号,下同);H2O只做氧化剂的是_____;属于氧化还原反应,但反应物中的H2O既不被氧化也不被还原的是________。
(4)反应2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O能制备氯气,该反应中,氧化剂是______________。反应中被氧化的HCl和未被氧化HCl的物质的量之比为________。
(5)铜与稀硫酸、双氧水混合能制备硫酸铜,写出反应的离子方程式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数, A的原子半径小于B,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素。E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子。
(1)基态E原子的价电子排布图_______________。
(2)B、C、D三元素第一电离能由大到小的顺序为(用元素符号表示)______________。
(3)BD![]() 中心原子杂化轨道的类型为______杂化;CA
中心原子杂化轨道的类型为______杂化;CA![]() 的空间构型为_______(用文字描述)。
的空间构型为_______(用文字描述)。
(4)1 mol BC-中含有π键的数目为______。
(5)比较D、E元素最简单氢化物的稳定性_______(填化学式,用“>”连接),理由是_______________。
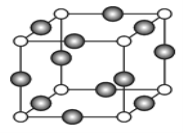
(6)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是____,C原子的配位数是_____。若相邻C原子和F原子间的距离为anm,阿伏伽德罗常数为NA,则该晶体的密度为______g/cm3(用含a、NA的符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有BaCl2和NaCl的混合溶液VL,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗amolH2SO4、bmolAgNO3。则原混合溶液中的c(Na+)为
A. ![]() mol/L B.
mol/L B. ![]() mol/L C.
mol/L C. ![]() mol/L D.
mol/L D. ![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F六种物质,它们的相互转化关系如下图(反应条件略,有些反应的产物和条件没有全部标出)。已知A、B、E是单质,B在常温下为气体,C俗名称为烧碱,D为无色无味液体。
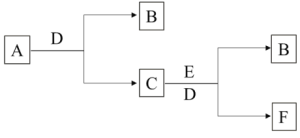
(1)写出A、D的化学式________。
(2)写出A和D反应生成B和C的化学方程式___________。
(3)写出E与C、D反应生成B和F的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量Fe、FeO、Fe2O3的混合物中,加入50mL1mol·L-1硫酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的混合物,能得到铁的质量为
A. 11.2g B. 2.8g C. 5.62g D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一块镁铝合金投入到1mol/L盐酸中,待合金完全溶解后(盐酸有剩余),再往溶液里加入1mol/LNaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积的变化如图所示。下列说法中错误的是( )
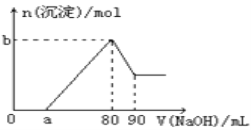
A. 盐酸的体积为80mL
B. a的取值范围为0<a<50
C. 当a值为30时,b值为0.01
D. n(Mg2+)<0.025mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是
A. 某溶液![]() 生成无色气体,说明原溶液中有CO32-
生成无色气体,说明原溶液中有CO32-
B. 某溶液![]() 溶液变为血红色,说明原溶液中有Fe2+
溶液变为血红色,说明原溶液中有Fe2+
C. 某溶液![]() 产生使湿润的红色石蕊试纸变蓝的气体,说明原溶液中有NH4+
产生使湿润的红色石蕊试纸变蓝的气体,说明原溶液中有NH4+
D. 某溶液![]() 有白色沉淀,说明原溶液中有SO42-
有白色沉淀,说明原溶液中有SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com