
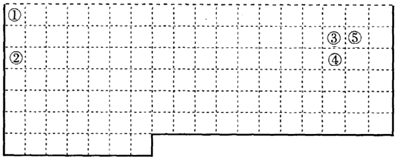
分析 (1)根据元素周期表的结构以及元素的分布情况来画;
(2)同周期从左到右非金属性逐渐增强,同主族自上而下非金属性逐渐减弱,非金属性越强氢化物越稳定;
(3)元素③是O元素,在一般的化合物中显负电性,在和F元素形成的化合物中呈现正化合价;
(4)X、Y和Z代表原子序数依次增大的三种短周期元素,它们满足以下条件,X和Y相邻,Y和Z也相邻,则这三种元素的位置关系为:同一周期或X和Y同一周期、X和Z同一主族或X和Y同一周期、Y和Z同一主族,X、Y和Z三种元素的原子最外层电子数之和为17,结合三种元素最外层电子数进行解答.
解答 解:根据元素周期表的结构和元素的分布,可推知:①为H,②为Na,③为O,④为S,⑤为F.
(1)元素周期表的结构以及元素的分布情况,表示元素周期表的部分边界如下: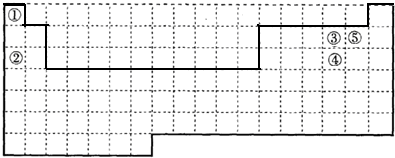
故答案为: ;
;
(2)元素③④⑤三种元素的非金属性F>O>S,非金属性越强氢化物越稳定,所以三种元素的氢化物由强到弱的顺序是HF>H2O>H2S,
故答案为:HF>H2O>H2S;
(3)元素③是O元素,在一般的化合物中显负电性,在和F元素形成的化合物中呈现正化合价,
故答案为:负(或-2),F(或氟)
(4)X、Y和Z代表原子序数依次增大的三种短周期元素,它们满足以下条件,X和Y相邻,Y和Z也相邻,则这三种元素的位置关系为:同一周期或X和Y同一周期、X和Z同一主族或X和Y同一周期、Y和Z同一主族,X、Y和Z三种元素的原子最外层电子数之和为17,
①若三种元素位于同一周期,则三种元素最外层电子数之和为Y最外层电子数的3倍,17不是3的倍数,所以该假设错误;
②若X和Y同一周期、X和Z同一主族,设x的最外层电子数是a,则Y在最外层电子数是a+1,Z的最外层电子数为a,所以三种元素最外层电子数之和=a+a+a+1=17,a不等于正整数,所以该假设错误;
③若X和Y同一周期、Y和Z同一主族,设X的最外层电子数是b,Y和Z的最外层电子数是b+1,所以三种元素最外层电子数之和=b+b+1+b+1=17,b=5,所以X是N元素,Y是O元素,Z是S元素,N不是表中编号①-⑤的元素,用元素符号标出为: ,
,
故答案为: .
.
点评 本题考查学生元素周期表和元素周期律的综合知识,要求学生具有分析和解决问题的能力,根据元素在周期表中的位置可推断出元素的种类,题中侧重于周期律的应用,学习中注意积累相关知识,把握正确的解题思路,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 元素 | 部分结构信息 | 部分性质信息 |
| X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2、X2O4等; |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸去除水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 乙醛与新制Cu(OH)2浊液反应:NaOH+CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O | |
| C. | 实验室用液溴和苯在催化剂作用下制溴苯: +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$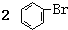 | |
| D. | 将CO2通入苯酚钠溶液: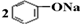 +CO2+H2O→ +CO2+H2O→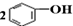 +Na2CO3 +Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数相同的原子,其核外电子排布也相同 | |
| B. | 质量数相同的不同原子,其化学性质一定相同 | |
| C. | 金属性越强,其原子在反应中越易失去电子 | |
| D. | 非金属性越强,其阴离子越难失去电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数是24 | |
| B. | 原子半径比硫原子的原子半径大 | |
| C. | 最高价氧化物是SeO3,是酸性氧化物 | |
| D. | 气态氢化物化学式是H2Se,还原性比HCl强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质都是离子化合物,弱电解质都是共价化合物 | |
| B. | 强电解质都是可溶性化合物,弱电解质都是难溶化合物 | |
| C. | 强电解质的水溶液导电能力强,弱电解质导电能力弱 | |
| D. | 强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键所致 | |
| B. | 由于NaCl晶体和CsCl晶体中正负离子半径比不相等,所以两晶体中离子的配位数不相等 | |
| C. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| D. | MgO的熔点比MgCl2高主要是因为MgO的晶格能比MgCl2大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 | |
| A | 发生中和反应 | - | Cu(OH)2溶解 | 产生氢气 |
| B | - | 有银镜 | 产生砖红色沉淀 | 产生氢气 |
| C | 发生水解反应 | 有银镜 | 产生砖红色沉淀 | - |
| D | 发生水解反应 | - | - | - |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com