
(12分)标准状况下,将224LHCl气体溶于635 mL水中,所得盐酸的密度为1.18 g·cm-3。试计算:(1)所得盐酸的质量分数和物质的量浓度是多少?
(2)取出这种盐酸100 mL,稀释至1.18 L,求所得稀盐酸的物质的量浓度。
⑴ n(HCl)=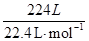 =10 mol,
=10 mol,
m(HCl)=10 mol×36.5 g·mol-1=365 g,
盐酸的质量分数w=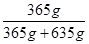 ×100%=36.5%,
×100%=36.5%,
c(HCl)=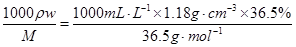 =11.8 mol·L-1。
=11.8 mol·L-1。
⑵根据c(浓)·V(浓)=c(稀)·V(稀)可知:
c(稀)=11.8 mol·L-1×0.1 L/1.18 L=1 mol·L-1。
解析试题解析:(1)n(HCl)=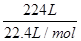 =10mol,m(HCl)=10mol×36.5g/mol=365g,溶液质量为365g+635mL
=10mol,m(HCl)=10mol×36.5g/mol=365g,溶液质量为365g+635mL
×1g/mL=1000g,则溶液的体积为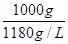 =0.847L,则c(HCl)=
=0.847L,则c(HCl)=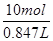 =11.8mol/L;②设稀释后
=11.8mol/L;②设稀释后
稀盐酸的物质的量浓度为cmol/L,根据稀释定律C浓V浓=C稀V稀可知:11.8mol/L×0.1L=cmol/L×1.18L,
所以X=01mol/L。
考点:物质的量浓度的相关计算


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:单选题
保护环境是每一个公民的责任。下列做法:①推广使用无磷洗衣粉;②城市垃圾分类处理;③ 推广使用一次性木质筷子;④推广使用清洁能源;⑤过量使用化肥、农药;⑥推广使用无氟冰箱。其中有利于保护环境的是( )
| A.①②④⑤ | B.②③④⑥ | C.①②④⑥ | D.③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(14分)实验题
下图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制200 mL 1.0 mol/L的稀硫酸。可供选用的仪器有: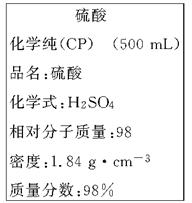
①玻璃棒;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
(1)配制上述稀硫酸时,还缺少的仪器有________________________(写仪器名称);
(2)标签所示浓硫酸的物质的量浓度为___________________________
(3)配制200 mL 1.0 mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为_______mL(计算结果保留小数点后1位),量取硫酸时应选用_______规格的量筒;
| A.10 mL | B.50 mL |
| C.100 mL | D.200 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
8分)用18.4mol·L-1密度为1.84g·mL-1的浓硫酸,配制100mL浓度为1mol·L-1的稀硫酸,其操作步骤如下:
| A.用量筒量取一定体积的浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,并用玻璃棒搅拌。 |
| B.用约30 mL蒸馏水,分成三次洗涤烧杯和玻璃棒,将每次洗涤液都注入容量瓶里。 |
| C.将稀释后的硫酸小心地用玻璃棒引流入容量瓶。 |
| D.继续向容量瓶中加蒸馏水,液面至刻度线下1cm~2cm。 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
甲乙两位同学分别用不同的方法配制100 mL 3.6 mol·L-1的稀硫酸。
(1)若采用18 mol·L-1的浓硫酸配制溶液,需要用到浓硫酸的体积为 。
(2)甲同学:量取浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100 mL容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
①将溶液转移到容量瓶中的正确操作是
。
②洗涤操作中,将洗涤烧杯后的洗液也注入容量瓶,其目的是 。
③定容的正确操作是 。
(3)乙同学:用100 mL量筒量取浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100 mL刻度线,再搅拌均匀。你认为此法是否正确?若不正确,指出其中错误之处
。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(每空1分,共8分)实验室需要配制0.1 mol/L CuSO4溶液480 mL。按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、_______ _、________以及等质量的两片滤纸。
(2)计算,应选择下列正确________
| A.需要CuSO4固体8.0g | B.需要CuSO4·5H2O晶体12.0 g |
| C.需要CuSO4·5H2O晶体12.5 g | D.需要CuSO4固体7.7 g |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(10分)某实验小组用MnO2与浓盐酸混合加热制取Cl2,并将制得的氯气与潮湿的Ca(OH)2固体反应制取少量漂白粉。实验装置如下图: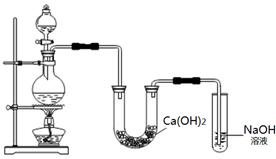
回答下列问题。
(1)漂白粉的有效成分是 (写化学式)。
(2)烧瓶中发生反应的化学方程式是 。
(3)温度较高时氯气与消石灰发生反应:6Cl2 + 6Ca(OH)2=5CaCl2 + Ca(ClO3)2 + 6H2O,该反应的氧化剂是 ,还原剂是 ,若反应消耗0.3mol Cl2,转移的电子数为 mol。
(4)在中学化学中,常用作氧化剂的物质有 、 (写两种),常用作还原剂的物质有 、
(写两种)。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(共14分)已知化合物A与B、丙与丁的组成元素分别相同,且四种物质中都含有同一种元素。A与B在常温下均呈液态。D与F都为固体单质,且D、 F与甲的浓溶液在常温下都会出现钝化现象,加热时有大量气体产生。(相关转化及部分反应条件和生成物未标出)。
(1)A的结构式 , E与F的反应是 (填反应名称),写出2种该反应在工业生产中的用途: 、 。
(2)若反应①除生成甲外,还生成丙,写出过量D与甲的稀溶液反应的离子方程式:
(3)若A与丙可以化合生成甲;D与甲的浓溶液加热条件下可以生成三种化合物乙、丙、B,写出下列化学方程式②: ③:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com