
 向200mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉至过量,产生气体的量随铁粉质量增加的变化如图所示(假定硝酸只被还原为NO).则下列说法中,正确的是( )
向200mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉至过量,产生气体的量随铁粉质量增加的变化如图所示(假定硝酸只被还原为NO).则下列说法中,正确的是( )| A. | OA段产生的是NO和H2的混合气 | B. | BC段产生的全部是NO | ||
| C. | Fe2(SO4)3是最终的溶质 | D. | H2SO4的物质的量浓度是2 mol/L |
分析 由图象可知,开始生成气体,中间气体体积不变,后段气体体积增大,故OA段发生反应为Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,以此来解答.
解答 解:A.OA段发生反应为Fe+NO3-+4H+=Fe3++NO↑+2H2O,气体只有NO,故A错误;
B.BC段发生反应为:Fe+2H+=Fe2++H2↑,气体只有氢气,故B错误;
C.加入铁粉至过量,Fe与Fe2(SO4)3反应,则最终溶质为FeSO4,故C错误;
D.由图中C点可知,n(Fe)=$\frac{22.4g}{56g/mol}$=0.4mol,由最终溶质为FeSO4,结合硫酸根离子守恒可知H2SO4为0.4mol,H2SO4的物质的量浓度是$\frac{0.4mol}{0.2L}$=2 mol/L,故D正确;
故选D.
点评 本题考查氧化还原反应的计算,为高频考点,把握图象与反应的对应关系为解答的关键,侧重分析与计算能力的考查,注意守恒法应用及最终溶质的判断,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
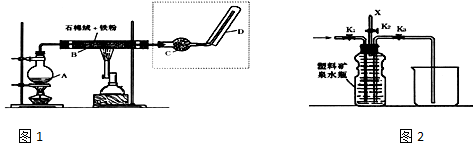
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用图1表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用图1表示:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
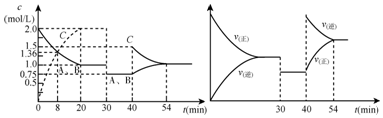
| A. | 30min时降低温度,40min时升高温度 | |
| B. | 8min前A的平均反应速率为0.16mol/(L•min) | |
| C. | 反应方程式中的x=1,正反应为吸热反应 | |
| D. | 20min~40min间该反应的平衡常数均为4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
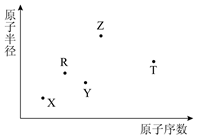 短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.Y与Z能形成Z2Y、Z2Y2型离子化合物,R原子最外层电子数是电子层数的2倍,Z与T形成的化合物Z2T能破坏水的电离平衡.下列说法正确的是( )
短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.Y与Z能形成Z2Y、Z2Y2型离子化合物,R原子最外层电子数是电子层数的2倍,Z与T形成的化合物Z2T能破坏水的电离平衡.下列说法正确的是( )| A. | 最高价氧化物对应水化物的酸性R>T | |
| B. | 氢化物的沸点一定是Y>R | |
| C. | 原子半径和离子半径均满足Y<Z | |
| D. | 由X、Y、Z、T四种元素组成的化合物中既含有离子键又含有共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com