
| 时间(min) 浓度(mol•L-1) 物质 | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
分析 (1)根据盖斯定律来写出碳与水蒸气反应生成一氧化碳和氢气的热化学方程式;根据反应能否自发进行的判据来回答;
(2)反应前后是气体体积不变的反应,图表数据分析可知一氧化氮,氮气,二氧化碳浓度都增大,说明改变的条件是缩小体积增大浓度,或加入一氧化氮达到新平衡后个物质浓度增大;
(3)到达平衡时转化率最大,令平衡时CO的浓度变化量为cmol/L,根据三段式法用c表示出平衡时各组分个浓度,再利用平衡常数列方程,求出c,再利用转化率定义计算.
解答 解:(1)已知①C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ•mol-1
②CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41.3kJ•mol-1
根据盖斯定律,将①-②可得:C(s)+2H2O(g)=CO2(g)+2H2(g)△H=+90kJ•mol-1,反应的焓变△H>0,△S>0,根据反应自发进行的判据
△H-TS<0,所以需要高温下发生,
故答案为:C(s)+2H2O(g)=CO2(g)+2H2(g)△H=+90.0 kJ•mol-1;高温;
(2)①10~20min内,N2的平均反应速率v(N2)=$\frac{0.25-0.16}{20-10}$mol/(L•min)=0.009 mol/(L•min),
故答案为:0.009 mol/(L•min);
②30min后,只改变某一条件,反应重新达到平衡,图表数据分析可知一氧化氮,氮气,二氧化碳浓度都增大;
A.通入一定量的NO,反应正向进行,达到平衡后一氧化氮、氮气、二氧化碳浓度增大,故符合;
B.加入一定量的活性炭是固体,对平衡无影响,故不符合;
C.加入合适的催化剂,只能改变化学反应速率,不能改变平衡,浓度不变,故不符合;
D.适当缩小容器的体积,反应前后是气体体积不变的反应,平衡不动,但个物质浓度增大,符合要求,故符合;
故答案为:AD;
(3)设CO的浓度变化量为c,三段式法用c表示出平衡时各组分个浓度,
CO(g)+H2O(g)?H2(g)+CO2(g),
起始(mol/L):0.02 0.020 0 0
转化(mol/L):c c c c
平衡(mol/L):0.02-c 0.02-c c c
代入500℃时反应平衡常数有k=$\frac{c({H}_{2})c(C{O}_{2})}{c(CO)c({H}_{2}O)}$=$\frac{{c}^{2}}{(0.02-c)^{2}}$=9,解得c=0.015,
CO的最大所以转化率为$\frac{0.015}{0.02}$×100%=75%,
故答案为:75%.
点评 本题综合性较大,涉及化学反应自发性判断、化学平衡常数、化学平衡影响因素、等效平衡计算等,题目难度中等.


科目:高中化学 来源: 题型:解答题
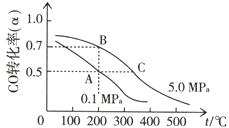 “洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000kJ•m-3的煤炭气,其主要成分是CO和H2.CO和H2可作为能源和化工原料,应用十分广泛.
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000kJ•m-3的煤炭气,其主要成分是CO和H2.CO和H2可作为能源和化工原料,应用十分广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入22.4LSO2参加反应时,有2 NA个电子发生转移 | |
| B. | 上述实验条件下,物质的氧化性:Cu2+>I2>SO2 | |
| C. | 滴加KI溶液时,KI被氧化,CuI是氧化产物 | |
| D. | 通入SO2后溶液逐渐变成无色,体现了SO2的漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2通入CaCl2溶液中 | B. | NO2通入FeSO4溶液中 | ||
| C. | NH3通入A1C13溶液中 | D. | SO2通入Ba(NO3)2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
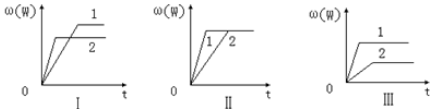
| A. | 图Ⅰ可能是不同压强对反应的影响,且P2>P1,m+n<p | |
| B. | 图Ⅱ可能是不同压强对反应的影响,且P1>P2,m+n=p | |
| C. | 图Ⅲ可能是不同温度对反应的影响,且T1>T2,△H<0 | |
| D. | 若m+n<p,△H>0,则该反应在低温下容易自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,48 g O3中的氧原子数为3NA | |
| B. | 24 g金属镁变为镁离子时失去的电子数为NA | |
| C. | 4℃时9 mL水和标准状况下11.2 L氮气中的原子数均为NA | |
| D. | 2 mol•L-l的CuCl2溶液中含有的氯离子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
| KW/10-14 | 0.114 | 0.292 | 0.681 | 1.00 | 2.92 | 5.47 | 55.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 0~6 min内,反应的平均速率v(Cl2)=0.15 mol•L-1•min -1 | |
| B. | 若保持温度不变,在第7 min 向体系中加入这三种物质各2 mol,则平衡向正反应方向移动 | |
| C. | 随温度升高,该反应平衡常数减小;比较第8 min反应温度T(8)与第15 min反应温度T(15)的高低:T(8)>T(15) | |
| D. | 若将初始投料浓度变为c(Cl2)=0.7 mol/L、c(CO)=0.5 mol/L、c(COCl2)=0.5 mol/L,保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6 min时Cl2的体积分数相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com