
【题目】现有以下几种有机物:
①CH4②CH3CH2OH③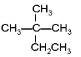 ④癸烷⑤CH2=CH2⑥
④癸烷⑤CH2=CH2⑥![]() ⑦
⑦![]() ⑧
⑧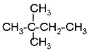 ⑨丙烷
⑨丙烷
请根据上述给出的物质按要求回答下列问题:
(1)相对分子质量为44的烷烃的结构简式为_____________;它与⑧互为_____________关系;
(2)与③互为同分异构体的是_____________(填序号);
(3)在120℃,1.01×105Pa条件下,某种气态烃与足量的O2完全反应后,测得反应前后气体的体积没有发生改变,则该烃是_____________(填序号);
(4)用“>”表示①③④⑨熔沸点高低顺序:_____________(填序号);
(5)具有特殊气味,常作萃取剂的有机物在催化剂的条件下与液溴发生反应的化学方程式_____________;
(6)有机物②在加热条件下和CuO反应的化学方程式_____________;
【答案】CH3CH2CH3 同系物 ⑦ ①⑤ ④>③>⑨>① ![]() +Br2
+Br2![]() +HBr CH3CH2OH+CuO
+HBr CH3CH2OH+CuO![]() CH3CHO+Cu+H2O
CH3CHO+Cu+H2O
【解析】
根据烷烃的通式、同系物和同分异构体的概念分析判断;根据烃的燃烧通式分析判断;苯和液溴在催化剂作用下发生取代反应;乙醇能被弱氧化剂氧化,在加热条件下与CuO反应生成乙醛。
(1)烷烃的通式为:CnH2n+2,相对分子质量为44的烷烃,则12n+2n+2=44,所以n=3,即烷烃的分子式为C3H8,结构简式为CH3CH2CH3;它与⑧( )的结构相似,且分子组成相差3个CH2基团,两者互为同系物;
)的结构相似,且分子组成相差3个CH2基团,两者互为同系物;
(2)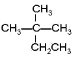 和
和![]() 分子式均为C6H14,且结构不同,两者互为同分异构体,即与③互为同分异构体的是⑦;
分子式均为C6H14,且结构不同,两者互为同分异构体,即与③互为同分异构体的是⑦;
(3)在120℃,1.01×105Pa条件下,生成的水为气态,由CxHy+(x+![]() )O2
)O2![]() xCO2+
xCO2+![]() H2O(g),则 1+(x+
H2O(g),则 1+(x+![]() )=x+
)=x+![]() ,解得y=4,即分子式中氢原子数目为4,为甲烷或乙烯,序号为①⑤;
,解得y=4,即分子式中氢原子数目为4,为甲烷或乙烯,序号为①⑤;
(4)烷烃中碳原子个数越多,沸点越大,相同碳原子个数的烷烃中支链多的沸点低,则沸点为④>③>⑨>①;
(5)苯在催化剂的条件下与液溴发生取代反应生成溴苯和HBr,反应的化学方程式为![]() +Br2
+Br2![]() +HBr;
+HBr;
(6)乙醇与CuO反应生成乙醛、Cu和水,反应的化学方程式为CH3CH2OH+CuO![]() CH3CHO+Cu+H2O。
CH3CHO+Cu+H2O。


科目:高中化学 来源: 题型:
【题目】B、E、H是生活中常见的有机物,H常用于食品包装,A的产量是石油化工发展水平的标志。根据如图转化关系回答问题:
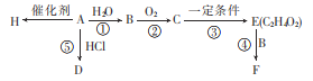
(1)写出A和F中官能团的名称:A___,F___。
(2)反应①、④的反应类型分别为___、___。
(3)写出D和E的结构简式:D___、E___。
(4)请写出下列反应的化学方程式:
I.写出反应②在催化剂存在的条件下并加热的化学方程式:___。
II.A→H的化学方程式:___。
(5)H是一种常见的高分子材料,由这种材料造成的环境问题是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是_________mol;
(2)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是____________,又变为棕黄色的原因是用离子方程式解释____________;
(3)在100mL FeBr2溶液中通入标况下2.24LCl2,溶液中有1/4的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是我们生活中必不可少的物质。将NaCl溶于水配成1 mol·L-1的溶液,溶解过程如图所示,下列说法正确的是
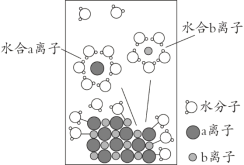
A. a离子为Na+
B. 溶液中含有NA个Na+
C. 水合b离子的图示不科学
D. 室温下测定该NaCl溶液的pH小于7,是由于Cl-水解导致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性K2Cr2O7溶液可与FeSO4溶液反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是
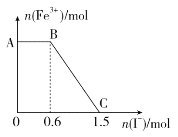
A. 图中AB段的氧化剂为K2Cr2O7
B. 开始加入的K2Cr2O7为0.25 mol
C. K2Cr2O7与FeSO4反应的物质的量之比为1∶3
D. 图中BC段发生的反应为2Fe3++2I-===2Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.55mol/LNaOH溶液和0.50mol/LHCl溶液进行中和热的测定。测定中和热的实验装置如图所示。

(1)从实验装置上看,图中缺少的一种玻璃仪器__________。
(2)使用补全仪器后的装置进行实验,取50mL0.50mol/LHCl溶液与50mL0.55mol/LNaOH溶液在小烧杯中进行中和反应,实验数据如表。
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值(t2-t1)/℃ | ||
HCl | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ______℃ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
①请填写表中的空白:温度差平均值__________℃
②上述实验数值结果比中和热57.3kJ/mol偏小,产生的原因可能是______。(填字母)
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度
(3)实验中若用60mL0.25mol/LH2SO4溶液跟50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量______(填“相等”、“不相等”),所求中和热______(填“相等”、“不相等”),若用50mL0.50mol/L醋酸代替HCl溶液进行上述实验,测得反应前后温度的变化值会______(填“偏大”、“偏小”、“不受影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法错误的是
A.3.6 g C60与C50组成的混合物中。含有的电子数目为1.8NA
B.6.72 L(标准状况)Cl2与足量乙烷反应时,断裂的C-H键数目为0.3NA
C.0.1 L浓度均为2 mol/L的(NH4)2SO4、NH4Cl溶液中,NH4+数目前者比后者多0.2 NA
D.0.1 mol H3BO3[电离方程式:H3BO3+H2O![]() H++B(OH)4-]消耗OH-数目最多为0.1 NA
H++B(OH)4-]消耗OH-数目最多为0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)是第VA族元素,其单质主要用于制造合金、半导体。三氧化二锑俗称锑白,是白色粉末,不溶于水,是一种两性氧化物,主要用于白色颜料、油漆和塑料、石油化工等。某工厂用羽毛矿(主要成分为Pb4FeSb6S14)制取锑白的工艺流程如图所示:

(1)Pb4FeSb6S14中的锑元素只显一种化合价,则其化合价是______。X是一种固体单质,其成分是___(填化学式)。
(2)氯化浸出中,除铅与X外,被氧化的元素反应后均显高价,写出相应的化学方程式:______________。操作1为加水稀释,写出生成SbOCl的离子方程式:___________。
(3)试剂1通常选用氨水而不是NaOH溶液,最可能的原因是_______。操作2的内容是_________、干燥。
(4)在强碱性条件下电解Na3SbS3溶液(原理如图)可得到单质锑。

写出阴极的电极反应式:_______,B电极应接电源的______极,当有2 mol Sb生成时,通过阳离子交换膜的离子数为_________(设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是

A. 用经水湿润的pH试纸测量溶液的pH
B. 将4.0 g NaOH固体置于100 mL容量瓶中,加水至刻度,配制1.000 mol·L1NaOH溶液
C. 用装置甲蒸干AlCl3溶液制无水AlCl3固体
D. 用装置乙除去实验室所制乙烯中的少量SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com