
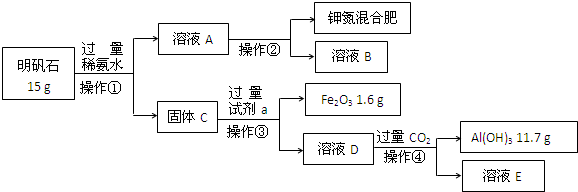
| 11.7g |
| 78g/mol |
| 4.05g |
| 15g |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
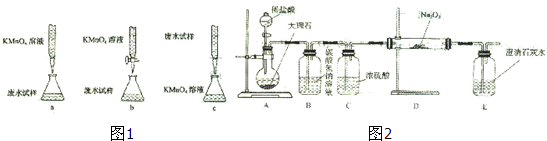
| 试剂X |
2- 4 |
| Ⅰ加盐酸ⅡBaCl2溶液 |
| Ⅲ系列操作 |
| 称量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、在蒸馏烧瓶中盛约
| ||
| B、收集到的液体取少量滴入硝酸银和稀硝酸,无明显现象 | ||
| C、冷水从冷凝管下口进,上口出 | ||
| D、将温度计水银球插到蒸馏烧瓶内的自来水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等于2V mL |
| B、小于2V mL |
| C、大于2V mL |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
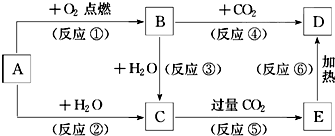 下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色.
下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com