
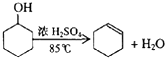
 已知甲酸(HCOOH)是羧酸中组成最简单的酸,它具有羧酸的性质,在实验室里常用甲酸在浓硫酸的作用下制取少量一氧化碳,现用甲酸与甲醇反应制取甲酸甲酯来验证甲酸具有能发生酯化反应的性质,装置如图所示
已知甲酸(HCOOH)是羧酸中组成最简单的酸,它具有羧酸的性质,在实验室里常用甲酸在浓硫酸的作用下制取少量一氧化碳,现用甲酸与甲醇反应制取甲酸甲酯来验证甲酸具有能发生酯化反应的性质,装置如图所示| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
| 方案 | 反应物 |
| 甲 | Cu、浓硝酸 |
| 乙 | Cu、稀硝酸 |
| 丙 | Cu、O2、稀硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||||
B、
| ||||
| C、Na和K属于ⅠA族元素,Na的金属性比K强 | ||||
| D、Cl和Br属于VⅡA族元素,两原子核外电子数之差为8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
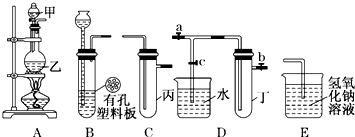
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 品红溶液褪色 | 氯气有漂白性 |
| Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应的产物具有酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、加入Na2SO4可以使溶液由a点变到b点 |
| B、通过蒸发可以使溶液由d点变到c点 |
| C、a、b、c、d点溶液中Kw相等 |
| D、a点对应的Ksp大于c点对应的Ksp |
查看答案和解析>>
科目:高中化学 来源: 题型:
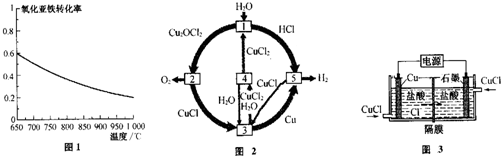
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10到15秒内c(NH3) 增加量等于0.25mol?L-1 |
| B、10秒内氨气的平均反应速率为0.025mol?L-1?s-1 |
| C、达平衡后,分离出少量NH3,v正增大 |
| D、该反应的逆反应的活化能不小于92.2kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
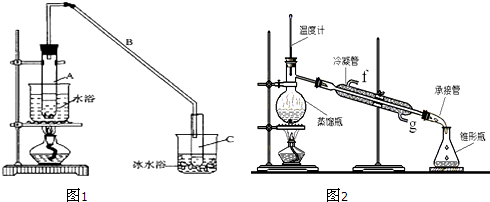
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 熔点(℃) | |
| 环乙醇 | 0.96 | 25 | 161 | 难溶于水 |
| 环乙烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com