
 H++HB-;HB-
H++HB-;HB- H++B2-;现有溶液 0.10mol/L、100ml,试回答以下问题:
H++B2-;现有溶液 0.10mol/L、100ml,试回答以下问题: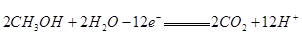


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.除去MgCl2溶液中少量的FeCl3,可选用MgCO3 |
| B.稀硫酸中加入Zn粉,随着反应的进行,溶液中水的电离程度逐渐增大 |
| C.能溶解氧化铝的溶液中可能大量存在:HCO3-、SO42-、NO3-、Na+ |
| D.等物质的量浓度的(NH4)2SO4溶液和(NH4)2CO3溶液中NH4+浓度前者大于后者 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓度为0.lmol/LCuSO4溶液,温度升高,溶液的pH降低 |
| B.—元酸与—元碱恰好完全反应后的溶液中—定存在c(H+)=c(OH-) |
C.浓度相同的AlCl3、NH3 H2O、Ba(OH2)三物质的溶液,等体积混合时没有沉淀生成 H2O、Ba(OH2)三物质的溶液,等体积混合时没有沉淀生成 |
| D.在所有能够溶解Al(OH)3的溶液中Cu2+、ClO-、Cl-、 Ca2+一定能够大量共存 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- |
| B.在强碱溶液中:Na+、K+、AlO2-、CO32- |
| C.在c(H+)=10—13 mol/L的溶液中:NH4+、Al3+、SO42-、NO3- |
| D.在pH=1的溶液中:K+、Fe2+、Cl—、NO3— |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| ①H2SO4溶液中的HSO4– | ②NaHSO4溶液中的HSO4– | ③CH3COOH | ④HCl溶液 |
| 10% | 29% | 1.33% | 100% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该溶液中一定不含Ba2+ 、Mg2+、A13+、SiO32-、Cl- |
| B.该溶液中一定含有K+、AlO2-、CO32-、Cl- |
| C.该溶液是否有K+ 需做焰色反应(透过蓝色钴玻璃片) |
| D.可能含有Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cu2+、NH4+、Br-、OH- | B.K+、Ba2+、OH-、SO42- |
| C.Ag+、NO3-、Cl-、K+ | D.Cl-、SO42-、K+、Na+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com