
| A. | 除去CO2中混有的少量HCl气体,可将其通过饱和Na2CO3溶液 | |
| B. | 铁粉中混有少量铝粉,可加入NaOH溶液,充分反应后过滤除去 | |
| C. | 将某化合物进行焰色实验,观察焰色为黄色,说明不含K+ | |
| D. | 向某溶液中加入BaCl2溶液,产生大量白色沉淀,说明溶液中含有SO42- |
分析 A、碳酸钠均可以和二氧化碳、HCl之间反应;
B、金属铝可以和氢氧化钠之间反应,但是金属铁不可以;
C、焰色实验,含钠元素的物质焰色为黄色,含钾元素的透过钴玻璃显示紫色;
D、和氯化钡反应可以产生白色的沉淀可以是氯化银还可以是硫酸钡.
解答 解:A、因为饱和碳酸钠溶液均可以和二氧化碳、HCl之间反应,所以不符合除杂原则,故A错误;
B、金属铝可以和氢氧化钠之间反应,但是金属铁不可以,铁粉中混有少量铝粉,可加入NaOH溶液,充分反应后过滤除去,故B正确;
C、焰色实验,含钠元素的物质焰色为黄色,含钾元素的透过钴玻璃显示紫色,化合物进行焰色实验,观察焰色为黄色,但是不能确定是否含有K+,故C错误;
D、和氯化钡反应可以产生白色的沉淀可以是氯化银还可以是硫酸钡,某溶液中加入BaCl2溶液,产生大量白色沉淀,说明溶液中含有硫酸根离子或是银离子,故D错误.
故选B.
点评 本题涉及物质的检验和除杂知识,物质的分离与除杂是重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)的熵增 | |
| B. | 铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 | |
| C. | 常温下Ksp(Ag2CrO4)=1.1×10-12,Ksp(AgCl)=1.8×10-10,则Ag2CrO4的溶解度小于AgCl | |
| D. | 等体积、物质的量浓度的HA与NaA(HA为弱酸)混合溶液,其酸碱性取决于Ka(HA)的大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
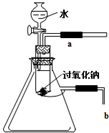 用脱脂棉包住0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.
用脱脂棉包住0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②③ | B. | 只有①②③ | C. | 只有①③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | K2SO4、HNO3、BaCl2 | B. | NaOH、NaCl、CuCl2 | ||
| C. | BaCl2、Na2CO3、HCl | D. | KCl、H2SO4、AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若c(CH3COOH)=0.1mol/L,反应后的溶液中:c(CH3COO-)+c(OH-)=c(Na+)+c(H+) | |
| B. | 若c(CH3COOH)=0.1mol/L,反应后的溶液中:c(OH-)>c(CH3COOH)+c(H+) | |
| C. | 若c(CH3COOH)=0.2mol/L,反应后的溶液中:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+) | |
| D. | 若反应后的溶液呈中性,则:c(CH3COOH)+c(CH3COO-)>0.05mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com