
【题目】CO2和CH4在一定条件下合成乙酸:CO2+CH4![]() CH3COOH。完成下列填空:
CH3COOH。完成下列填空:
(1)①写出碳原子最外电子层的轨道表示式______
②钛(Ti)是22号元素,它是______(选填编号)
a.主族元素 b.副族元素 c.短周期元素 d.长周期元素
(2)CS2分子的电子式为______;其熔沸点比CO2高,原因是______常温下,向1L pH=10的 NaOH溶液中持续通入CO2。通入CO2的体积(V)与溶液中水电离产生的OH﹣离子浓度(c)的关系如图所示
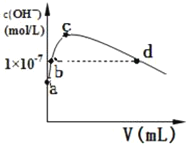
(3)c点溶液中离子浓度由大至小的关系是:______
(4)a点溶液中由水电离产生的c(H+)=______;b点溶液中c(H+)______1×10﹣7mol/L(填写“等于”、“大于”或“小于”)
(5)能使0.1mol/L乙酸溶液的电离程度以及pH都增大的是______(选填序号)
a.加水稀释 b.加入少量乙酸钠固体 c.通氯化氢 d.加入少量苛性钠固体
【答案】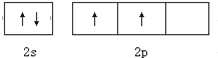 bd
bd ![]() 二者都为分子晶体,相对分子质量越大,分子间作用力越大 c(Na+)>c(CO32﹣)>c(HCO 3﹣) 1×10﹣10mol/L 小于 ad
二者都为分子晶体,相对分子质量越大,分子间作用力越大 c(Na+)>c(CO32﹣)>c(HCO 3﹣) 1×10﹣10mol/L 小于 ad
【解析】
(1)①C原子共2个电子层,最外层电子为2s、2p电子;
②钛(Ti)是22号元素,位于第四周期ⅣB族;
(2)CS2的电子式类似于CO2,二者都为分子晶体,相对分子质量越大,熔点越高;
(3)当水电离出的OH离子浓度最大时,说明此时的溶液是碳酸钠溶液,对水的电离起促进作用;
(4)水电离出的氢离子与氢氧根离子的浓度始终相等,a是没有通二氧化碳的情况,即pH=10的NaOH溶液,结合水的离子常数分析求解;b点是强碱溶液对水的电离起抑制作用,所以溶液中的c(H+)<1×107mol/L;
(5)电离程度增大,电离平衡应正向移动,且pH增大,则酸性减弱,以此来解答。
(1)①C原子共2个电子层,最外层电子为2s、2p电子,最外电子层的轨道表示式为![]() ,故答案为:
,故答案为:![]() ;
;
②钛(Ti)是22号元素,位于第四周期ⅣB族,为长周期副族元素,故答案为:bd;
(2)CS2的电子式类似于CO2,电子式为![]() ,二者都为分子晶体,相对分子质量越大,分子间作用力越大,则熔点越高,故答案为:
,二者都为分子晶体,相对分子质量越大,分子间作用力越大,则熔点越高,故答案为:![]() ;二者都为分子晶体,相对分子质量越大,分子间作用力越大;
;二者都为分子晶体,相对分子质量越大,分子间作用力越大;
(3)当水电离出的OH离子浓度最大时,说明此时的溶液是碳酸钠溶液,对水的电离起促进作用,所以离子溶液浓度大小为c(Na+)>c(CO32﹣)>c(HCO3﹣),故答案为:c(Na+)>c(CO32﹣)>c(HCO3﹣);
(4)水电离出的氢离子与氢氧根离子的浓度始终相等,a是没有通二氧化碳的情况,即pH=10的NaOH溶液,则c(H+)=1×1010mol/L,而氢离子来源于水的电离,所以水电离出的c(H+)=1×1010mol/L,b点是强碱溶液对水的电离起抑制作用,所以溶液中的c(H+)<1×107mol/L,故答案为:1×1010mol/L;小于;
(5)a.加水稀释,促进电离,且氢离子浓度减小,pH增大,故选;
b.加入少量乙酸钠固体,抑制电离,电离程度减小,故不选;
c.通氯化氢,酸性增强,pH减小,故不选;
d.加入少量苛性钠固体,促进电离,且氢离子浓度减小,pH增大,故选;
故答案为:ad。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是( )
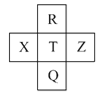
A.非金属性:Z<T<X
B.R与Q的电子数相差26
C.气态氢化物稳定性:R<T<Q
D.最高价氧化物的水化物的酸性:R>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
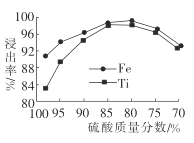
【题目】金属钛在航天、潜海和医疗方面应用广泛。以钛铁矿[主要成分为钛酸亚铁(FeTiO3),含少量Fe2O3]为原料制备钛的工艺流程如图所示。

(1)步骤②、③、④中,均需进行的操作是_____________(填操作名称)。
(2)滤液1中钛元素以TiO2+形式存在,步骤①中生成TiO2+的化学方程式为__________,硫酸质量分数对钛、铁浸出率的影响如图所示.据此判断,酸浸时所加硫酸的质量分数应为______(填范围)。.
(3)请结合离子方程式解释步骤④中加热水的原因:__________。
(4)电解法制备Ti的装置是以石墨为阳极,TiO2为阴极,熔融CaO为电解质。Ti在_______(填“阳极”或“阴极”)生成,____(填“能”或“不能”)将熔融CaO换成石灰乳。
(5)以绿矾为原料,可以制备重要工业原料氧化铁,基本流程如下:
![]()
①绿矾溶液中离子浓度由大到小的顺序为__________。
②FeCO3达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+ )=1.0×10-5 mol·L-1。所得FeCO3中_____(填“含”或“不含”)有Fe(OH)2。已知: {Ksp[Fe(OH)2]= 4.9×10-17}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A经李比希法和质谱法分析得知其分子式为C8H8O2,相对分子质量为 136,A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环,且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图。关于A的下列说法中不正确的是( )
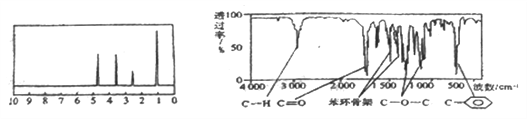
A. A分子属于酯类化合物,在一定条件下能发生水解反应
B. A在一定条件下可与3 mol H2发生加成反应
C. 符合题中A分子结构特征的有机物只有一种
D. 与A属于同类化合物的同分异构体只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由碳、氢、氧三种元素组成的有机物![]() 的相对分子质量为102,所含氢元素的质量分数为
的相对分子质量为102,所含氢元素的质量分数为![]() ,分子中氢原子数为氧原子数的5倍。
,分子中氢原子数为氧原子数的5倍。
(1)![]() 的分子式是______。
的分子式是______。
(2)![]() 中含有2个不同的含氧官能团,分别为羟基和醛基。一定条件下,
中含有2个不同的含氧官能团,分别为羟基和醛基。一定条件下,![]() 与氢气反应生成
与氢气反应生成![]() ,
,![]() 分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团,则
分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团,则![]() 的结构简式为______。
的结构简式为______。
(3)写出两个与![]() 具有相同官能团,并带有支链的同分异构体的结构简式:_____________________。
具有相同官能团,并带有支链的同分异构体的结构简式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。请回答以下问题:

(1)认真分析上图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小(最小)范围为________<Al<________(填元素符号)。
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是________。
(3)上图中第一电离能最小的元素在周期表中的位置是________。
(4)根据对角线规则,Be、Al元素最高氧化物的水化物性质相似,它们都具有________,其中Be(OH)2显示这种性质的离子方程式是 __________________________、_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如图.下列说法正确的是( )
![]()
A.x<yB.SO2是该反应的催化剂
C.MFe2Ox是还原剂D.氧化性:MFe2Oy>SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )

A. Mg 电极是该电池的正极
B. H2O2在石墨电极上发生氧化反应
C. 石墨电极附近溶液的pH 增大
D. 溶液中Cl-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行行:Cd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
A.充电时阴极反应:Cd(OH)2+2e- = Cd+2OH-
B.充电过程阳极附近溶液的碱性增强
C.放电时电能转化为化学能
D.放电时电解质溶液中消耗1molH2O时电路中通过2mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com