
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | | 315 | |
| 熔点/℃ | -70.0 | -107.2 | | | |
| 升华温度/℃ | 180 | 300 | 162 |
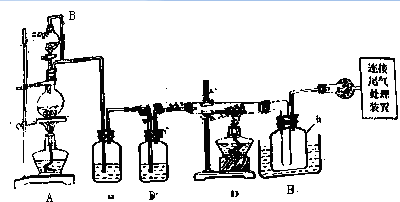
分析 由制备四氯化硅的实验流程可知,A中发生二氧化锰与浓盐酸的反应生成氯气,B中饱和食盐水除去HCl,C装置中浓硫酸干燥氯气,D中发生Si与氯气的反应生成四氯化硅,由信息可知,E装置制取氢气,F可防止倒吸,最后氢气还原SiCl4,
(1)装置A中g管使分液漏斗和烧瓶连通;装置C中的试剂应该吸收水而不能吸收氯气;产物SiCl4沸点低;
(2)D中氯气与粗硅反应生成SiCl4,h瓶收集粗产物,精馏粗产品可得高纯度四氯化硅,由表中数据可以看出,蒸出SiCl4气体时,BCl3早已成气体被蒸出,而AlCl3、FeCl3、PCl5升华温度均低于SiCl4.
解答 解:由制备四氯化硅的实验流程可知,A中发生二氧化锰与浓盐酸的反应生成氯气,B中饱和食盐水除去HCl,C装置中浓硫酸干燥氯气,D中发生Si与氯气的反应生成四氯化硅,由信息可知,E装置制取氢气,F可防止倒吸,最后氢气还原SiCl4,
(1)浓盐酸有挥发性,故分液漏斗要加盖,加盖后如没有g管,则盐酸就不易流下去,g管的作用是平衡压强,使液体顺利流出并防止漏气;制得的氯气中含有氯化氢和水,装置B用饱和食盐水除去氯化氢,装置C用浓硫酸吸水;产物SiCl4沸点低,需要冷凝收集,
故答案为:平衡压强;浓硫酸;使SiCl4冷凝收集;
(2)D中氯气与粗硅反应生成SiCl4,h瓶收集粗产物,精馏粗产品可得高纯度四氯化硅,由表中数据可以看出,蒸出SiCl4气体时,BCl3早已成气体被蒸出,而AlCl3、FeCl3、PCl5升华温度均低于SiCl4,所以当SiCl4蒸出后,而AlCl3、FeCl3、PCl5还为固体留在瓶里,
故答案为:Al、P.
点评 本题考查制备实验方案的设计,综合了氯气的制法、硅的提纯等实验知识,注意把握制备原理及实验流程中的反应、物质的性质等为解答的关键,侧重分析与实验能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 常温下氯气与烧碱溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | AlCl3溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 金属钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| D. | 铜与稀硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有在生物体内才能合成的物质 | B. | 有机物都是含有碳元素的化合物 | ||
| C. | 有机化合物都能燃烧 | D. | 含有碳元素的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
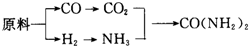
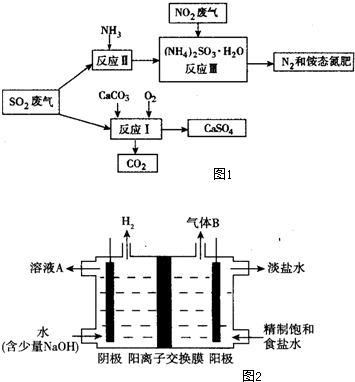
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu$→_{v}^{O_{2}}$CuO$\stackrel{H_{2}SO_{4}}{→}$CuSO4溶液$\stackrel{结晶}{→}$CuSO4•5H2O | |
| B. | Al$→_{v}^{O_{2}}$Al2O3$\stackrel{{H}_{2}S{O}_{4}}{→}$Al2(SO4)3溶液$\stackrel{加热蒸干}{→}$Al2(SO4)3 | |
| C. | FeSO4溶液$\stackrel{{H}_{2}S}{→}$FeS$→_{干燥}^{过滤}$FeS晶体 | |
| D. | MgCl2溶液$→_{过滤}^{NH_{3}}$Mg(OH)2$\stackrel{适量HN{O}_{3}}{→}$Mg(NO3)2溶液$\stackrel{结晶}{→}$Mg(NO3)•6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )的废水可以通过构成微生物电池除去,其原理如图所示.
)的废水可以通过构成微生物电池除去,其原理如图所示.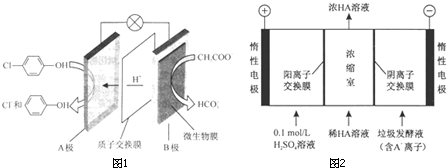
 -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-.
-OH+Cl-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴乙烷与NaOH水溶液混合加热后,经冷却,加入硝酸银溶液有淡黄色沉淀 | |
| B. | 淀粉在硫酸作用下水解得到葡萄糖,再加入新制银氨溶液并水浴加热,可得银镜 | |
| C. | 检验溴乙烷消去产物中的乙烯,可将反应逸出的气体直接通入酸性KMnO4溶液中 | |
| D. | 通过核磁共振氢谱的方法,可以检验出溴乙烷在NaOH水溶液中水解的产物有乙醇生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com