
【题目】关于下列装置说法正确的是( )

A. 装置②中滴入酚酞,a极附近变红B. 装置①中,一段时间后SO42﹣浓度增大
C. 用装置③精炼铜时,c极为粗铜D. 装置④中发生吸氧腐蚀
【答案】A
【解析】
A、电解时,b是阳极、a是阴极,阳极上生成氯气、阴极上生成氢气,且阴极附近有NaOH生成,溶液呈碱性;
B、装置①是原电池,溶液中SO42-不参加反应;
C、电解精炼粗铜时,粗铜作阳极、纯铜作阴极;
D、强酸性条件下,锌发生析氢腐蚀,弱酸性或中性条件下,锌发生吸氧腐蚀。
A、电解时,b是阳极、a是阴极,阳极上生成氯气、阴极上生成氢气,且阴极附近有NaOH生成,溶液呈碱性,所以滴入酚酞后a电极附近溶液呈红色,故A正确;
B、装置①是原电池,溶液中SO42-不参加反应,所以放电过程中硫酸根离子浓度不变,故B错误;
C、电解精炼粗铜时,粗铜作阳极、纯铜作阴极,用装置③精炼铜时,d极为粗铜,故C错误;
D、强酸性条件下,锌发生析氢腐蚀,弱酸性或中性条件下,锌发生吸氧腐蚀,该溶液呈强酸性,所以应该发生析氢腐蚀,故D错误;
故选A。


科目:高中化学 来源: 题型:
【题目】某工厂将制革工业污泥中的铬元素以难溶物CrOH(H2O)5SO4的形式回收,工艺流程如下,其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
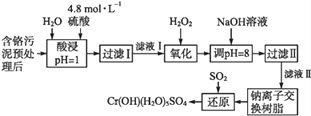
回答下列问题:
(1)4.8 mol/L的硫酸溶液密度为1.27g/cm3,该溶液中硫酸的质量分数是_______。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:______。
(3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — | — |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
①Cr (OH)3溶解于NaOH溶液时反应的离子方程式是___________。
②加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。滤液Ⅱ中阳离子主要有______;但溶液的pH不能超过8,其理由是______________________________。
(4)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是_____________。
(5)写出上述流程中用SO2进行还原时发生反应的化学方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 :2SO2(g)+ O2(g)![]() 2SO3(g) △H= -QkJ/mol,在温度一定、容积为2L的密闭容器中分别进行下列三个实验:充分作用后,测得实验1反应放出的热量为Q1kJ,实验2没有热量变化,则下列说法中不正确的是( )
2SO3(g) △H= -QkJ/mol,在温度一定、容积为2L的密闭容器中分别进行下列三个实验:充分作用后,测得实验1反应放出的热量为Q1kJ,实验2没有热量变化,则下列说法中不正确的是( )
实验编号 | SO2(g) | O2(g) | SO3(g) |
1. | 2mol | 1mol | 0mol |
2. | 1mol | 0.5mol | 1mol |
3. | 1mol | 0.8mol | 1.4mol |
A. 实验1放出的热量值为Q1=0.5Q B. 该条件下的平衡常数为4
C. 实验1中O2的转化率为50% D. 实验3反应放出热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物合成、应用及氮的固定一直是科学研究的热点。
(1) 以CO2与NH3为原料合成化肥尿素的主要反应如下:
① 2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47 kJ·mol1
② NH2CO2NH4(s)=CO (NH2)2(s)+H2O(g);ΔH=a kJ·mol1
③ 2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98 kJ·mol1
则a为____。
(2) 尿素可用于湿法烟气脱氮工艺,其反应原理为:NO+NO2+H2O=2HNO2;2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
① 当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)=____(空气中氧气的体积含量大约为20%)。
② 如图表示尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为____%。

(3)用稀硝酸吸收NOx,得到HNO3和HNO2(弱酸)的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:____。
(4)利用脱氮菌可净化低浓度NO废气。当废气在塔内停留时间均为90s的情况下,测得不同条件下NO的脱氮率如图所示。

① 由图知,当废气中的NO含量增加时,宜选用____法提高脱氮的效率。
② 图Ⅱ中,循环吸收液加入Fe2+、Mn2+,提高了脱氮的效率,其可能原因为____。
(5)研究表明:NaClO/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。图所示为复合吸收剂组成一定时,温度对脱硫脱硝的影响。温度高于60℃后,NO去除率下降的原因为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 镁条投入浓硫酸中:Mg+2H+=Mg2++H2↑
B. 用惰性电极电解氯化铝溶液:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C. 向硫酸铁溶液中加入铜粉:Fe3++Cu=Fe2++Cu2+
D. 向偏铝酸钠溶液中通入足量二氧化碳:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下,向0.1mol·L-1的醋酸溶液中加水稀释,溶液中c(H+)/c(CH3COOH)增大
B. 反应N2(g)+3H2(g) ![]() 2NH3(g) (△H<0)达平衡后,降低温度,正反应速率增大、逆反应速率减小,平衡向正反应方向移动
2NH3(g) (△H<0)达平衡后,降低温度,正反应速率增大、逆反应速率减小,平衡向正反应方向移动
C. 镀锌铁板是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的
D. 电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
①CH3OH(g)+3/2O2(g)![]() CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
②CO(g)+1/2O2(g)![]() CO2(g) ΔH=-283.0 kJ·mol-1
CO2(g) ΔH=-283.0 kJ·mol-1
③H2(g)+1/2O2(g)![]() H2O(l) ΔH=-285.8 kJ·mol-1
H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2 (g)![]() CH3OH(g) ΔH=________ kJ·mol-1。
CH3OH(g) ΔH=________ kJ·mol-1。
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________(填写序号)。
a. 使用高效催化剂 b. 降低反应温度
c. 增大体系压强 d. 不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。
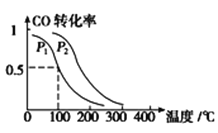
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=_______;
③100℃时,达到平衡后,保持压强P1不变的情况下,再向容器中通入CO、H2和CH3OH各0.5a mol,则平衡_______ (填“向右”、“向左”或“不”移动)。
④在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
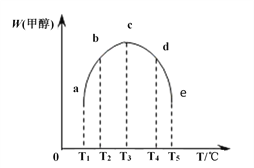
(4)在容积均为1L的密闭容器(a、b、c、d、e)中,分别充入1molCO和2molH2等量混合气体,在不同的温度下(温度分别为T1、T2、T3、T4、T5),经相同的时间,在t时刻,测得容器甲醇的体积分数如图所示。在T1- T2及T4- T5两个温度区间,容器内甲醇的体积分数的变化趋势如图所示,其原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】解释下列事实所用的方程式不合理的是
A. 硫酸酸化的KI淀粉溶液久置后变蓝:4I-+O2 +4H+=2I2+2H2O
B. 将充有NO2的玻璃球浸到热水中,气体颜色加深:2NO2(g)![]() N2O4(g) △H>0
N2O4(g) △H>0
C. 用Na2CO3溶液处理锅炉水垢中的硫酸钙:CO32- +CaSO4 =CaCO3 +SO42-
D. 以KOH溶液为电解质溶液,氢氧燃料电池的负极区pH减小:H2+2OH--2e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸钠(![]() ,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A–。已知25 ℃时,HA的Ka=6.25×10–5,H2CO3的Ka1=4.17×10–7,Ka2=4.90×10–11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法正确的是(温度为25 ℃,不考虑饮料中其他成分)( )
,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A–。已知25 ℃时,HA的Ka=6.25×10–5,H2CO3的Ka1=4.17×10–7,Ka2=4.90×10–11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法正确的是(温度为25 ℃,不考虑饮料中其他成分)( )
A. 相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
B. 当pH为5.0时,饮料中c(HA) /c(A–)=0.16
C. 提高CO2充气压力,饮料中c(A–)不变
D. 碳酸饮料中各种粒子的浓度关系为:c(H+)=c(HCO3-)+c(CO32-)+c(OH–)–c(HA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com