
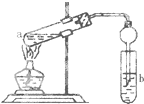
 如图,在试管a中先加入3mL 95%的乙醇,边摇动边缓缓加入2mL浓H2SO4并充分摇匀,冷却后再加入2mL冰醋酸,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.
如图,在试管a中先加入3mL 95%的乙醇,边摇动边缓缓加入2mL浓H2SO4并充分摇匀,冷却后再加入2mL冰醋酸,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、非金属元素组成的化合物中只可能含有共价键 |
| B、ⅦA族元素气态氢化物的热稳定性和还原性从上到下依次减弱 |
| C、第三周期非金属元素最高价含氧酸的酸性从左到右依次增强 |
| D、元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2+H2O═HCl+HClO |
| B、KClO3+6HCl═KCl+3Cl2↑+3H2O |
| C、2FeCl3+H2S═2FeCl2+S↓+2HCl |
| D、2H2O2═2H2O+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解氯化镁溶液:Mg2++2Cl-═Mg+Cl2↑ |
| B、碳酸镁悬浊液中加醋酸:CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O |
| C、酸性K2Cr2O7溶液可氧化双氧水H2O2:Cr2O72-+8H++5H2O2=2 Cr3++4O2↑+9H2O |
| D、氨水溶解氯化银沉淀的原理:AgCl+2 NH3?H2O=[Ag(NH3)2]++Cl-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生成是水分子中含有18O |
| B、生成的乙酸乙酯相对分子质量为88 |
| C、生成的乙酸乙酯的相对分子质量为90 |
| D、此反应是有限度的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
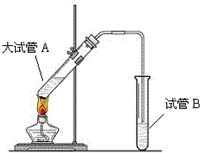 “酒是陈年的香”,是因为乙醇被少量氧气氧化,氧化产物与乙醇反应生成有香味的物质,实验室可以模拟后一过程.
“酒是陈年的香”,是因为乙醇被少量氧气氧化,氧化产物与乙醇反应生成有香味的物质,实验室可以模拟后一过程.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 预期实验目的或结论 |
| A | 室温下,用pH试纸测定浓度为0.1mol?L-1 Na2SiO3溶液和Na2CO3溶液的pH | 比较H2SiO3和H2CO3的酸性强弱 |
| B | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中含有SO42- |
| C | 向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| D | 将某气体通入淀粉和KI的混合溶液,溶液变蓝色 | 该气体一定是Cl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com