
| A. | 该反应前后氮元素的化合价不变 | |
| B. | 该反应中的四种物质晶体中都存在氢键 | |
| C. | 该反应中NH3、F2、NF3的分子中所有原子均共平面 | |
| D. | 该反应中NH3、F2、NF3三种物质的晶体均属于分子晶体 |
分析 A.反应中NH3→NF3氮元素的化合价由-3价→+3价;
B.F2、NF3、NH4F的晶体中不含氢键;
C.根据NH3、F2、NF3的空间构型判断;
D.由分子构成的晶体属于分子晶体.
解答 解:A.反应中NH3→NF3氮元素的化合价由-3价→+3价,则N元素的化合价发生变化,故A错误;
B.F2、NF3、NH4F的晶体中不含氢键,NH3的晶体中含有氢键,故B错误;
C.NH3属于三角锥形,分子中原子不共面,F2属于直线形分子,原子共面,NF3的空间与氨气相似,属于三角锥形,分子中所有原子不共面,故C错误;
D.由分子构成的晶体属于分子晶体,NH3、F2、NF3三种物质的晶体均属于分子晶体,故D正确.
故选D.
点评 本题考查了元素化合价的变化、氢键、分子的空间构型、晶体类型的判断,题目难度不大,侧重于基础知识的考查.


科目:高中化学 来源: 题型:选择题
| A. | 常温下,46g NO2和N2O4含有2nA个氧原子 | |
| B. | 1mol Na在空气中燃烧,转移2nA个电子 | |
| C. | 1L0.1mol•L-1CH3COOH溶液中含有0.1nA个H+ | |
| D. | 标况下,22.4LHF中含有nA个HF分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
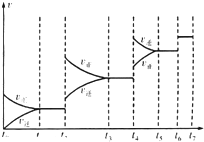 对碳硫及其化合物的研究有重要的意义.
对碳硫及其化合物的研究有重要的意义.| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | X | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | Y | t |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、D、E、G、L、M是核电荷数依次增大的6种短周期主族元素,其中A的原子序数与周期序数相等,D、G、L、M基态原子的最外能层均有2个未成对电子.R+核外有28个电子.请回答下列问题(用所对应的元素符号表示).
已知A、D、E、G、L、M是核电荷数依次增大的6种短周期主族元素,其中A的原子序数与周期序数相等,D、G、L、M基态原子的最外能层均有2个未成对电子.R+核外有28个电子.请回答下列问题(用所对应的元素符号表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | ||
| C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{cV}{x}$×100% | B. | $\frac{cV}{25x}$×100% | C. | $\frac{40cV}{x}$×100% | D. | $\frac{cV}{4x}$×100% |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一上月考二化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.碳酸钙难溶于水,放入水中溶液不导电,且碳酸钙在高温条件下分解,不存在熔融状态下的性质,故碳酸钙是非电解质
B.液态HCl、固体NaCl均不导电,所以液态HCl、固体NaCl均不是电解质
C.SO2溶于水后得到的水溶液导电,所以SO2是电解质
D.H3PO4晶体在熔融状态下不导电,但溶于水后其水溶液导电,故H3PO4是电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com