
| A. | 金属护栏表面涂漆 | B. | 地下钢管连接镁块 | ||
| C. | 汽车底盘喷涂高分子膜 | D. | 水中的钢闸门连接电源的正极 |
分析 A、涂漆能使金属隔绝空气和水;
B、钢管和镁连接能形成原电池;
C、高分子膜能将汽车底盘保护起来;
D、在电解池中,阳极被腐蚀,阴极被保护.
解答 解:A、对金属护栏涂油漆使金属和空气、水等物质隔离而防止生锈,故A错误;
B、钢管和镁连接能形成原电池,镁做负极被腐蚀,钢管做正极被保护,故B错误;
C、高分子膜能将汽车底盘保护起来,隔绝空气和水,能减缓金属的腐蚀,故C错误;
D、在电解池中,阳极被腐蚀,阴极被保护,故故钢闸门连接电源的正极会加快其腐蚀,故D正确.
故选D.
点评 本题考查了金属的腐蚀与防护,解答时要从钢铁生锈的条件方面进行分析、判断,从而找出科学的防锈方法,题目难度不大.


科目:高中化学 来源: 题型:解答题
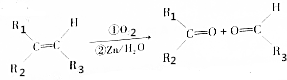
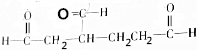 和
和 各1mol.
各1mol. ),产物与烃分子中原子个数相等的元素有C、H.
),产物与烃分子中原子个数相等的元素有C、H. 可简写为
可简写为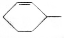 ,其中线表示化学键,线的端点、折点或交点表示碳原子,碳原子剩余的化合价用氢原子补足.写出A所有可能的结构简式:
,其中线表示化学键,线的端点、折点或交点表示碳原子,碳原子剩余的化合价用氢原子补足.写出A所有可能的结构简式: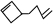 、
、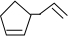 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
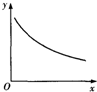 在某密闭容器中充入H2S和O2,发生反应:2H2S(g)+O2(g)?S2(g)+2H2O(g)△H<0,达到平衡后,若仅改变横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势符合图象的是( )
在某密闭容器中充入H2S和O2,发生反应:2H2S(g)+O2(g)?S2(g)+2H2O(g)△H<0,达到平衡后,若仅改变横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势符合图象的是( )| 选项 | x | y |
| A | 温度 | 混合气体平均相对分子质量 |
| B | 压强 | S2气体体积分数 |
| C | 容器体积 | H2S浓度 |
| D | O2浓度 | 平衡常数 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A<B<C<D<E | |
| B. | 化合物AE与CE含有相同类型的化学键 | |
| C. | 简单气态氢化物的热稳定性:B>E | |
| D. | 一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广“低碳经济”,减少温室气体的排放 | |
| B. | 大力发展新能源,减少温室气体的排放 | |
| C. | 推广“绿色自由”计划,吸收空气中的CO2用廉价能源合成汽油 | |
| D. | 推广小火力发电站的兴建,缓解地方用电困难,促进地方经济的快速发展 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+ | B. | C032- | C. | OH- | D. | Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁的金属性比铝弱 | |
| B. | 镁和铝的氧化物都可以与盐酸反应 | |
| C. | 镁和铝的氧化物都可以与氢氧化钠溶液反应 | |
| D. | 镁和铝的工业制法都是通过电解他们对应的氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com