
下列各组离子在给定条件下能大量共存的是( )
A.在pH=1的溶液中:NH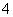 、K+、ClO-、Cl-
、K+、ClO-、Cl-
B.有SO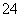 存在的溶液中:Na+、Mg2+、Ca2+、I-
存在的溶液中:Na+、Mg2+、Ca2+、I-
C.有NO 存在的强酸性溶液中:NH
存在的强酸性溶液中:NH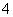 、Ba2+、Fe2+、Br-
、Ba2+、Fe2+、Br-
D.在[H+]=1.0×10-13 mol·L-1的溶液中:Na+、S2-、[Al(OH)4]-、SO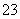
科目:高中化学 来源: 题型:
目前“低碳减排”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题。
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g) 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂表面积(S)和时间(I)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂表面积(S)和时间(I)的变化曲线如图所示。

据此判断:
①该反应的△H_____________0(填“>”或“<”)。
②在T2温度下,0-2s内的平均反应速率v(N2) =____________mol/(L·s)。
③当固体催化剂的质量一定时,增大其表面积可增大化学反应速率。若催化剂的表面积S1>S2,在答题卡相应图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_______________(填代号)。

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
例如:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ/mol
2NO2(g)=N2O4(g) △H=-867kJ/mol
写出CH4(g)催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式:_____________________。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用,以CO2(g)和H2O(g)为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应为_________________。

③常温下0. 1 mol/L的HCOONa溶液pH为10,则HCOOH的电离常数Ka =_______________mol·L-1(填写最终计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除去氧化膜、并用针刺一些小孔的铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待钠块反应完全后,在容器中仅收集到1.12 L氢气(标准状况),此时测得铝箔质量比反应前减少了0.27 g,水槽和容器内溶液的总体积为2.0 L,溶液中NaOH的浓度为0.050 mol·L-1(忽略溶液中离子的水解和溶解的氢气的量)。
(1)写出该实验中发生反应的化学方程式:
;
(2)试通过计算确定该钠块中钠元素的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )。
A.用加热法可除去Na2CO3中的NaHCO3
B.Na2CO3的热稳定性大于NaHCO3
C.可用石灰水区分Na2CO3与NaHCO3溶液
D.小苏打可中和胃酸、热纯碱可除去油污
查看答案和解析>>
科目:高中化学 来源: 题型:
很多微粒具有六元环的结构。
Ⅰ.六氯环三磷腈分子中包含一个六元环,是橡胶生产中的重要中间体,其结构如图所示,其熔点为113℃,在减压下,50℃即可升华。在有机溶剂中,六氯环三磷腈可由五氯化磷与氯化铵反应制得,反应的方程式为3PCl5+3NH4Cl====P3N3Cl6+12HCl。
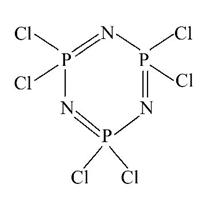
(1)比较磷元素和氯元素的第一电离能:P______Cl(填“>”或“<”)。
(2)在上述反应中断裂的化学键有________(填序号)。
A.离子键 B.配位键 C.极性键 D.非极性键
(3)P3N3Cl6的晶体类型为___________。
Ⅱ.1,3-戊二酮通过两步变化,也可以形成六元环,增加了分子的稳定性,其变化如图所示:
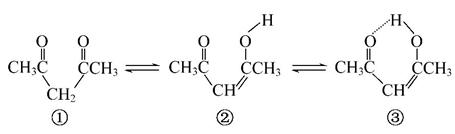
(4)由①转化为②时,π键数目________(填“增加”“减小”或“不变”)。
(5)由②转化为③时,③比②多增加了一种微粒间作用力,该作用力是__________。
Ⅲ.S和Ge可构成[Ge4S10]4-,锗和硫原子也连结成六边形结构,如图所示。
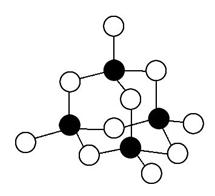
(6)锗原子的价电子排布式为_______。
(7)图中涂黑的微粒代表__________元素。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,[SO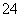 ]>[NH
]>[NH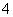 ]
]
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1 mol·L-1的氨水中加入少量硫酸铵固体,则溶液中 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
MOH和ROH两种一元碱的溶液分别加水稀释10n倍时,pH变化与n的关系如图所示。下列叙述中正确的是
( )
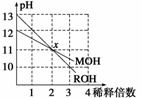
A.MOH和ROH都是强碱
B.稀释前,[ROH]=10[MOH]
C.常温下pH之和为14的醋酸和ROH溶液等体积混合,所得溶液呈碱性
D.在x点,[M+]=[R+]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com