
| A. | Li、C、O原子最外层电子数依次增加 | B. | P、S、Cl元素最高正化合价依次升高 | ||
| C. | N、O、F原子半径依次增大 | D. | Li、Na、K的金属性依次增强 |
分析 A.Li、C、O为同周期元素,原子序数大的最外层电子数大;
B.P、S、Cl为同周期元素,原子序数大的元素的最高正化合价大;
C.N、O、F为同周期元素,原子序数大的原子半径小;
D.Li、Na、K为同主族元素,原子序数大的金属性强.
解答 解:A.Li、C、O为同周期元素,Li、C、O原子最外层电子数分别为1、4、6,依次增加,故A正确;
B.P、S、Cl为同周期元素,最高正化合价分别为+5、+6、+7,依次升高,故B正确;
C.N、O、F为同周期元素,则原子半径依次依次减小,故C错误;
D.Li、Na、K为同主族元素,原子序数大的金属性强,则Li、Na、K的金属性依次增强,故D正确;
故选C.
点评 本题考查元素周期表和元素周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 所有自发进行的化学反应都是放热反应 | |
| B. | 放热反应一定比吸热反应的反应速率快 | |
| C. | 由焓判据和熵判据组合而成的复合判据,将更适合于所有的反应过程 | |
| D. | 反应速率快的反应,其反应物的转化率一定高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ]-.
]-.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发核能、太阳能、氢能等新能源,使用无磷洗涤剂都可直接降低碳排放 | |
| B. | 动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程 | |
| C. | 化石燃料和植物燃料燃烧时放出的能量均来源于太阳能 | |
| D. | 针对节能减排需要大力建设火力发电站 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
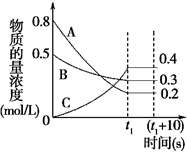 在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图.回答下列问题:
在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com