
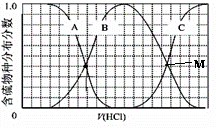
 向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量.其中H2S、HS-、S2-的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出).试分析:
向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量.其中H2S、HS-、S2-的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出).试分析:

科目:高中化学 来源: 题型:
| A、放热反应的反应速率一定大于吸热反应的反应速率 |
| B、熔融状态下能导电的化合物一定含离子键 |
| C、增大反应物浓度可加快反应速率,因此可用浓硫酸与铁反应增大生成氢气的速率 |
| D、在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阴极的阳极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定存在K+、NH4+、CO32-、SO42-,一定不存在Ba2+、Cl- |
| B、一定存在NH4+、Cl-、CO32-、SO42-,可能存在K+ |
| C、c(SO42-)=0.2mol?L-1,c(NH4+)>c(SO42-) |
| D、如果溶液中存在NH4+、Cl-、CO32-、SO42-、K+五种离子,则c(K+)>0.2mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验及现象 | 可能的原因 | |
| A | 向氯化亚铁溶液中滴加几滴硫氰化钾溶液,再通人氯气,最后溶液不呈红色 | 过量的氯气将硫氰化钾氧化 |
| B | 点燃从玻璃导管导出的甲烷时,看到黄色火焰 | 玻璃中含有钠元素 |
| C | 新配制的氢氧化铜浊液中加入乙醛溶液并加热有黑色沉淀生成 | 温度过高使乙醛脱水碳化 |
| D | 用锌粒和稀硫酸制备氢气时,加入几滴硫酸铜溶液后,产生气体的速度大大加快 | 形成了原电池,反应速率加快 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(CH3COO-)c(H+) |
| c(CH3COOH) |
| 1.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度正反应速率加快,逆反应速率减慢 |
| B、0.1molA2和0.2molB2反应达到平衡时生成0.2molAB2 |
| C、达平衡后,升高温度,正、逆反应速率均加快,B的转化率不变 |
| D、催化剂可同等程度改变正逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com