
【题目】(1)已知17g H2R中含1mol H,则R的摩尔质量为__________。
(2)同温同压下,等体积的NH3气和H2S气的质量之比为__________。
(3)若由NH3和H2S组成的混合气体的平均相对分子质量为20.4,则混合气中NH3和H2S的分子数之比为__________。
(4)配制500mL 0.2mol/L Na2CO3溶液,需要用托盘天平称量![]() 晶体的质量为__________ g。
晶体的质量为__________ g。
(5)将a L标准状况下的氯化氢气体溶于100mL水中(水的密度近似为1g/mL),得到密度为ρ g/mL的盐酸,则该盐酸的物质的量浓度是____________________mol/L。
【答案】32g/mol 1:2 4:1 28.6 ![]()
【解析】
(1)17g H2R中含1mol H,M(H2R)=![]() =34g·mol-1, 则R的摩尔质量为(34-2)g·mol-1=32g·mol-1。
=34g·mol-1, 则R的摩尔质量为(34-2)g·mol-1=32g·mol-1。
(2)同温同压下,等体积的NH3气和H2S气的质量之比为17:34=1:2。
(3)设NH3和H2S的物质的量分别为xmol、ymol,则:![]() =20.4,整理可得x:y=4:1;
=20.4,整理可得x:y=4:1;
(4)配制500mL 0.2mol/L Na2CO3溶液,需要用托盘天平称量![]() 晶体的质量为:n(Na2CO3)=0.5L×0.2mol·L-1=0.1mol,m(Na2CO3·10H2O)=0.1mol×286g·mol-1=28.6g;
晶体的质量为:n(Na2CO3)=0.5L×0.2mol·L-1=0.1mol,m(Na2CO3·10H2O)=0.1mol×286g·mol-1=28.6g;
(5)将a L标准状况下的氯化氢气体溶于100mL水中(水的密度近似为1g/mL),得到密度为ρ g/mL的盐酸,则该盐酸的物质的量浓度是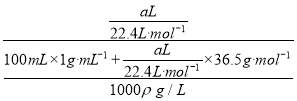 =
=![]() mol·L-1。
mol·L-1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关化合物X的叙述正确的是

A. X分子只存在2个手性碳原子
B. X分子能发生氧化、取代、消去反应
C. X分子中所有碳原子可能在同一平面上
D. 1 mol X与足量NaOH溶液反应,最多消耗3 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。说法正确的是( )
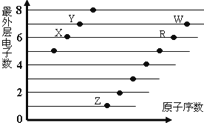
A. X与W形成的化合物中只有共价键
B. X与Z形成的化合物中只有离子键
C. 元素的非金属性:X>R>W
D. 简单离子的半径:W>R>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一般较强酸可制取较弱酸,这是复分解反应的规律之一。已知在常温下测得浓度均为0.1mol/L的下列 3 种溶液的 pH:
溶质 | NaHCO3 | Na2CO3 | NaClO |
pH | 8.34 | 11.6 | 10.3 |
下列有关说法正确的是( )
A. 以上溶液的 pH 是用广泛 pH 试纸测定的
B. 反应CO2+H2O+2NaClO=Na2CO3+2HClO可以发生
C. 室温下,电离常数: K2( H2CO3)>K( HClO)
D. 在新制氯水中加入少量 NaHCO3固体可以提高溶液中 HClO 的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒的空间构型相同的是
①NH3和H2O ②NH4+和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和C2H2 ⑥SiO44-和SO42-
A. ②⑤B. ②③⑥C. ①②③④D. ③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国《Scinece》杂志曾报道科学家合成和分离出含高能正离子![]() 的化合物N5AsF6,有研究者预想合成一个纯粹由氮组成的新物种
的化合物N5AsF6,有研究者预想合成一个纯粹由氮组成的新物种 ![]() ,若
,若![]() 离子中每个氮原子均满足8电子结构,下列关于含氮微粒的表述正确的是
离子中每个氮原子均满足8电子结构,下列关于含氮微粒的表述正确的是
A. ![]() 中N原子间形成离子键B. N5AsF6中As的化合价为+1
中N原子间形成离子键B. N5AsF6中As的化合价为+1
C. ![]() 的摩尔质量为112D.
的摩尔质量为112D. ![]() 所含质子数为21
所含质子数为21
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某种兴奋剂的结构简式如图所示。有关该物质的说法中正确的是
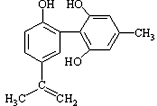
A. 该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
B. 滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
C. 1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为4mol和7mol
D. 该分子中的所有碳原子不可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以炼锌烟尘(主要成分为ZnO,含少量CuO和FeO)为原料,制取氯化锌晶体的工艺流程如下:
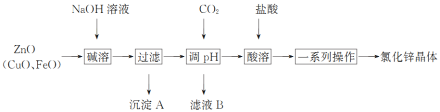
已知:Zn及其化合物的性质与Al及其化合物的性质相似,pH>11时,Zn(OH)2能溶于NaOH溶液生成ZnO22—。
(1)“调pH”步骤中通入过量CO2时发生反应的化学方程式为________;“酸溶”时发生反应的离子方程式为___________。
(2)下列说法不正确的是_______。
A 加入过量NaOH溶液的目的是提高锌元素的浸取率
B 沉淀A的主要成分是CuO、FeO
C 洗涤沉淀时,直接将洗涤剂加入漏斗,并用玻璃棒轻轻搅拌
D 利用结晶法可以从氯化锌溶液中获得氯化锌晶体
(3)流程中需进行蒸发浓缩,在实验室中进行蒸发浓缩的具体操作是_____。
(4)氯化锌晶体是白色晶体,可含1、1.5、2.5、3、4个结晶水,易潮解,易溶于水,溶于乙醇、丙酮。由氯化锌晶体制备无水氯化锌的装置如图,其中滴液漏斗中盛放的是SOCl2(SOCl2熔点为105 ℃、沸点为78.8 ℃、遇水剧烈水解生成两种酸性气体)。
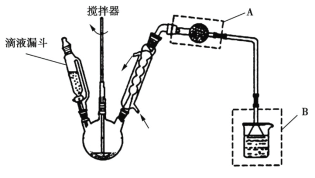
①下列物质中最适合洗涤氯化锌晶体的是_________。
A 冷水 B 浓盐酸 C 乙醇 D 氨水
②仪器A的名称为_______;装置B的作用是_________。
③以ZnCl2·H2O为例,写出三颈烧瓶中发生反应的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p2;②1s22s22p63s23p3;③1s22s22p4;④1s22s22p3。则下列有关比较中正确的是( )
A. 电负性:④>③>②>①
B. 原子半径:③>④>②>①
C. 第一电离能:④>③>②>①
D. 最高正化合价:③>④=②>①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com