

分析 (1)醋酸为弱电解质,滴定过程中pH变化较盐酸缓慢,滴定终点时,溶液呈碱性;盐酸是强电解质,滴定终点时,出现突变;
(2)醋酸为弱电解质,滴定过程中pH变化较盐酸缓慢,滴定终点时n(CH3COOH)=n(NaOH),据此计算;
(3)滴定醋酸溶液的曲线是图2,根据电荷守恒,c(Na+)=c(CH3COO-)时,c(OH-)=c(H+);
(4)根据溶液的组成结合弱离子的水解来判断;
(5)用0.1000mol•L-1 NaOH溶液滴定未知浓度的CH3COOH溶液,在滴定过程中,可以分为三种情况:恰好完全反应;酸剩余;碱剩余,根据溶液的组成来确定离子浓度的大小关系即可;
(6)根据酸碱中和的实质以及碱的稀释原理结合溶液的pH=-lgc(H+)、Kw=c(H+)•c(OH-)来计算.
解答 解:(1)醋酸为弱电解质,滴定过程中pH变化较盐酸缓慢,滴定终点时溶液呈碱性,则滴定醋酸溶液的曲线是图2,滴定盐酸溶液的曲线是图1,故答案为:图1;
(2)醋酸为弱电解质,滴定过程中pH变化较盐酸缓慢,滴定终点时溶液呈碱性,滴定终点时n(CH3COOH)=n(NaOH),则a=20.00mL,故答案为:20.00;
(3)滴定醋酸溶液的曲线是图2,根据电荷守恒,c(Na+)=c(CH3COO-)时,c(OH-)=c(H+),溶液显示中性,此时pH=7,即c(Na+)=c(CH3COO-)的点是D,故答案为:D;
(4)醋酸和氢氧化钠的物质的量相等,得到的是醋酸钠溶液,此时溶液显示碱性,离子浓度关系式:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(5)用0.1000mol•L-1 NaOH溶液滴定未知浓度的CH3COOH溶液,在滴定过程中,可以有如下情况:恰好完全反应,此时溶液的组成为醋酸钠,离子浓度大小关系是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);故d错误;
酸剩余,此时溶液的组成为醋酸钠和醋酸,溶液显示酸性,若剩余的酸较多,离子浓度大小关系是:c(CH3COO-)>c(H+)>c(Na+)>c(OH-),故a正确;如果c(H+)>c(OH-)>c(Na+)>c(CH3COO-),得到c(H+)+c(Na+)>c(OH-)+c(CH3COO-),不符合电荷守恒,故b错误;若碱过量,得到氢氧化钠和醋酸钠的混合物,可以存在:c(Na+)>c(CH3COO-)=c(OH-)>c(H+),故c正确.
故选bd;
(6)0.1mol•L-1 NaOH溶液1L用a L水稀释,得到溶液的pH=12,则$\frac{0.1mol/L×1L}{1L+aL}$=0.01mol/L,解得a=9L,
用pH=2盐酸b L中和使其pH=12,则$\frac{0.1mol/L×1L-0.01mol/L×bL}{1L+bL}$=0.01mol/L,解得b=4.5,所以$\frac{a}{b}$=2,故答案为:2.
点评 本题涉及弱酸的电离平衡、酸碱中和滴定以及酸碱混合液pH的计算等知识,属于综合知识的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | SO2的摩尔质量是64g | |
| B. | 常温常压下,64gSO2中所含的分子数约为6.02×1023个 | |
| C. | 1molSO2的质量是64g/mol | |
| D. | 常温常压下,1molSO2的体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油分馏所得的馏分仍是混合物 | |
| B. | 天然气的主要成分是甲烷、乙烯等气体 | |
| C. | 煤焦油经分馏可得苯和甲苯 | |
| D. | 含C20以上的重油经催化裂化可得汽油、柴油等轻质油 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2011年深圳大运会“虹”火炬采用丙烷为燃料.丙烷热值较高,污染较小,是一种优良的燃料.试回答下列问题:
2011年深圳大运会“虹”火炬采用丙烷为燃料.丙烷热值较高,污染较小,是一种优良的燃料.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO2发生了氧化反应 | |
| B. | MnOOH中Mn元素的化合价为+3 | |
| C. | 反应消耗 0.65g Zn,有0.01 mol电子发生转移 | |
| D. | 碱性锌锰电池是一种高效、环境友好的发电装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
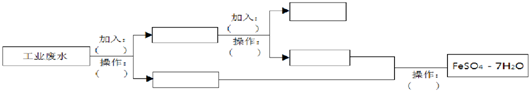
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com