
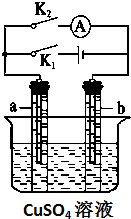
 如图所示,某同学按照图装置进行如下实验,请回答下列问题:
如图所示,某同学按照图装置进行如下实验,请回答下列问题:

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.05×10-4 |
| B、2.03×10-4 |
| C、1.28×10-4? |
| D、2.90×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
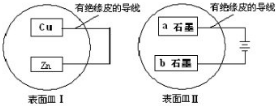
| A、表面皿Ⅰ和表面皿Ⅱ中溶液pH不断升高 |
| B、锌片和石墨a均发生氧化反应.铜片和石墨a上均有H2放出 |
| C、表面皿Ⅰ溶液中c(Zn2+)浓度增大 |
| D、石墨b附近滴加酚酞变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:
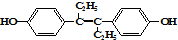 下列叙述中正确的是( )
下列叙述中正确的是( )| A、该有机物分子中,最多可能有18个碳原子共平面 |
| B、分子中有7个碳碳双键,可以与氢气1:7加成 |
| C、该分子对称性好,所以没有顺反异构 |
| D、该分子中有2个H,2个O,6个C共直线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
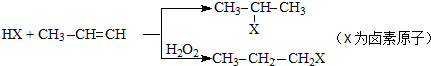
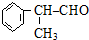 ,该物质是一种香料.
,该物质是一种香料.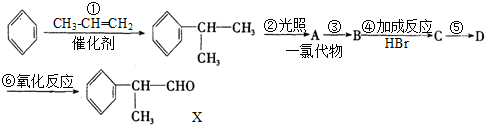
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com