
| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
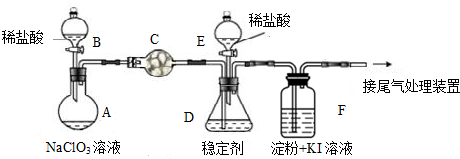
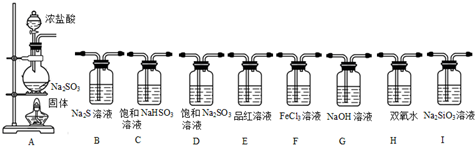
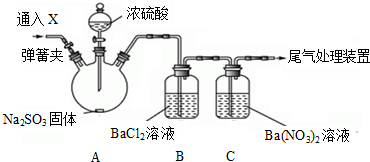

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)═c(OH-)+c(A-) | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| C. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)═c(H+)+c(CH3COOH) | |
| D. | 0.1mol•L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸盛放在玻璃试剂瓶中 | |
| B. | 浓硝酸盛在棕色试剂瓶中 | |
| C. | 氢氧化钠溶液盛在带橡皮塞的玻璃瓶中 | |
| D. | 氯水盛在棕色试剂瓶中,并放置在冷暗处 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有0.1 mol•L-1 Fe3+的溶液中:H+、Fe2+、Na+、I- | |
| B. | 强碱性溶液中:K+、Al3+、Cl-、SO42- | |
| C. | 在pH=1的溶液中:Mg2+、Na+、ClO-、NO3- | |
| D. | 加入强碱再加热,既有气体放出又有沉淀生成的溶液:Ca2+、HCO3-、NH4+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金属镁在目前的汽车、航天、航空、机械制造、军事等产业中得判迅猛发展.
金属镁在目前的汽车、航天、航空、机械制造、军事等产业中得判迅猛发展.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com