
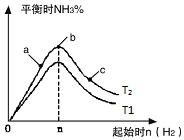
 在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ/mol,有关数据及特定平衡状态见表.
在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ/mol,有关数据及特定平衡状态见表.| 容器 | 起始投入 | 达平衡时 | |||
| 甲 | 2molN2 | 3molH2 | 0molNH3 | 1.5molNH3 | |
| 乙 | amolN2 | bmolH2 | 0molNH3] | 1.2molNH3 | |
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入氨气的物质的量 |
| y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时氨气的转化率 |
分析 (1)平衡后同种物质的体积分数相同,说明甲乙平衡状态相同,是等效平衡;依据图表数据和平衡三段式列式计算,气体压强之比等于气体物质的量之比;
(2)a.该反应是吸热反应,升高温度平衡向正反应方向移动,混合气体总物质的量增大;
b.平衡常数只与温度有关,温度改变平衡常数改变,升高温度平衡向正反应方向移动;
c.加入氢气,混合气体质量增大、但容器体积不变;
d.加入氨气,平衡向正反应方向移动,但其转化率减小;
(3)①该反应为放热反应,根据温度升高化学平衡向着吸热方向进行;
②根据增加反应物浓度(氢气)的物质的量化学平衡向着正反应方向移动;
③化学平衡三行计算列式计算,反应速率v=$\frac{△c}{△t}$计算,结合平衡计算H2的转化率为60%时放出的热量,若起始时向容器内放入2mol N2和6mol H2,相当于增大压强平衡正向进行,反应是可逆反应不能进行彻底,放出热量小于2×92.4kJ/mol=184.8KJ,大于H2的转化率为60%时放出的热量的2倍.
解答 解:(1)甲、乙两组实验中同种物质的体积分数相同,说明达到相同的平衡状态,乙容器体积V,$\frac{1.5mol}{5L}$=$\frac{1.2mol}{V}$,V=4L;根据三段式:
甲:N2+3H2?2NH3,
起始量 2 3 0
变化量 0.75 2.25 1.5
平衡量 1.25 0.75 1.5
乙:N2+3H2?2NH3,
起始量 a b 0
变化量 0.6 1.8 1.2
平衡量 a-0.6 b-1.8 1.2
$\frac{1.25mol}{5L}$=$\frac{(a-0.6)mol}{4L}$,得a=1.6mol,$\frac{0.75mol}{5L}$=$\frac{(b-1.8)mol}{4L}$.得b=2.4mol;起始时乙容器中的压强是甲容器的倍数为:$\frac{1.6mol+2.4mol}{2mol+3mol}$=0.8,乙的平衡常数k=$\frac{(1.2mol÷4L)^2}{(1mol÷4L)•(0.6mol÷4L)^3}$=107(mol/L)-2
故答案为:1.6mol; 0.8; 107(mol/L)-2
(2)a.该反应是吸热反应,升高温度平衡向正反应方向移动,混合气体总物质的量增大,混合气体总质量不变,平均相对分子质量减小,故a错误;
b.平衡常数只与温度有关,温度改变平衡常数改变,升高温度平衡向正反应方向移动,平衡常数增大,故b正确;
c.加入氢气,混合气体质量增大、但容器体积不变,混合气体密度增大,故c正确;
d.加入氨气,平衡向正反应方向移动,但其转化率减小,故d错误,
故答案为:bc;
(3)①为反应为放热反应,温度升高化学平衡向着吸热方向进行,从T1到T2生成物氨气的量增加,平衡正移,故T2<T1;
故答案为:低于;
②b点代表平衡状态,c点又加入了氢气,故平衡向右移动,氮气的转化率增大;
故答案为:c;
③化学平衡三段式计算列式计算,
N2(g)+3H2(g)?2NH3(g)
起始量(mol)1 3 0
变化量(mol)0.6 3×60% 1.2
平衡量(mol) 0.4 1.2 1.2
反应速率v=$\frac{1.2mol÷1L}{5min}$=0.24mol.L-1.min-1;此时反应放出热量=92.4kJ/mol×$\frac{1.8}{3}$=55.44KJ,结合平衡计算H2的转化率为60%时放出的热量,若起始时向容器内放入2mol N2和6mol H2,相当于增大压强平衡正向进行,反应是可逆反应不能进行彻底,放出热量小于2×92.4kJ/mol=184.8KJ,大于H2的转化率为60%时放出的热量的2倍,即热量>55.44KJ×2=110.88kJ.
故答案为:0.24mol.L-1.min-1;>.
点评 本题考查了影响化学反应速率的计算、外界条件对平衡的影响和化学平衡常数的书写,为高频考点,综合性较强,难度中等,注意化学反应原理的合理利用,掌握三段式解题法,加强计算能力的培养.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动 | |
| B. | 常温下,用蒸馏水不断稀释醋酸,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值变小 | |
| C. | 反应SiO2(s)+3C(s)=SiC(s)+2CO(g)室温下不能自发进行,则该反应的△H<0 | |
| D. | 对于Ca(OH)2的沉淀溶解平衡,升高温度,Ca(OH)2的溶解速率增大,Ksp减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中,9.6g 硫粉与 11.2g 铁粉混合加热生成硫化亚铁 17.6g 时,放出 19.12KJ 热量.则Fe(s)+S(s)═FeS(s)△H=-95.6KJ?mol-1 | |
| B. | 稀醋酸与 0.1mol?L-1NaOH 溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3KJ?mol-1 | |
| C. | 已知,1molH2 完全燃烧生成液态水所放出的热量为 285.5KJ,则水分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g)△H=-285.5KJ?mol-1 | |
| D. | 已知 2C(s)+O2(g)═2CO(g)△H=-221KJ?mol-1,则可知 C 的燃烧热△H=-110.5KJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HIO3 | B. | HIO2 | C. | HIO | D. | ICl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.40mol | B. | 小于0.20mol | ||
| C. | 大于0.20mol | D. | 小于0.40mol,大于0.20mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
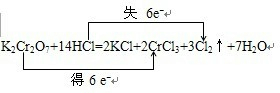 ;反应中1mol氧化剂得到 (填“得到”或“失去”)6mol电子.
;反应中1mol氧化剂得到 (填“得到”或“失去”)6mol电子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡常数减小 | B. | TiO2的质量不变 | C. | CO2的浓度不变 | D. | Ti的质量增加 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com