
| 序号 | 实验内容 | 实验现象 | 用离子方程式解释现象 |
| 实验Ⅰ | 向YZ的水溶液中,加入少许CCl4,逐滴滴加X单质的水溶液,振荡. | CCl4层颜色变成橙红色 | 发生反应的离子方程式是Cl2+2Br-=2Cl-+Br2. |
| 实验Ⅱ | 向上述溶液中加入少量YR的水溶液,振荡. | CCl4层颜色变成紫红色 | 发生反应的离子方程式是Br2+2I-=2Br-+I 2. |
分析 X、Y、Z、R是中学化学常见的4种主族元素,原子序数依次增大.Y在周期表前20号元素中原子半径最大,则Y为K元素;X、Y可以形成YX型离子化合物,X表现-1价,处于ⅦA族,且离子核外电子数相等,故X为Cl元素;Z、R可以形成共价分子RZ,两原子最外层均达到8电子结构,R显+1价,Z显-1价,R、Z原子最外层电子式均为7,则R、Z均处于ⅦA族,结合原子序数可知Z为Br、R为I,据此解答.
解答 解:X、Y、Z、R是中学化学常见的4种主族元素,原子序数依次增大.Y在周期表前20号元素中原子半径最大,则Y为K元素;X、Y可以形成YX型离子化合物,X表现-1价,处于ⅦA族,且离子核外电子数相等,故X为Cl元素;Z、R可以形成共价分子RZ,两原子最外层均达到8电子结构,R显+1价,Z显-1价,R、Z原子最外层电子式均为7,则R、Z均处于ⅦA族,结合原子序数可知Z为Br、R为I.
(1)K与水反应生成KOH与氢气,反应方程式为:2K+2H2O=2KOH+H2↑,
故答案为:2K+2H2O=2KOH+H2↑;
(2)R为I元素,元素在周期表中位于第五周期ⅦA族,
故答案为:五;ⅦA;
(3)根据原子结构理论预测:按X、Z、R顺序,原子核外电子层数依次递增,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱,所以X、Z、R三种元素的非金属性由强及弱的顺序是Cl>Br>I,
故答案为:原子核外电子层数依次递增;Cl>Br>I;
(4)实验Ⅰ:向KBr的水溶液中,加入少许CCl4,逐滴滴加氯水,发生反应:Cl2+2Br-=2Cl-+Br2,得到Br2被四氯化碳萃取,溶液分层,CCl4层颜色变为橙红色;
实验Ⅱ:向上述溶液中加入少量KI的水溶液,振荡,会发生反应:Br2+2I-=2Br-+I2,得到I2被四氯化碳萃取,溶液分层,CCl4层颜色变为紫红色;
乙同学分析后认为:用甲同学的实验设计比较R、Z的非金属性不够严谨,其理由可能是:实验I结束后Cl2可能剩余;
丙同学为了比较R、Z的非金属性,在甲同学方案的基础上补充设计了如下实验:向Y、Z、R简单离子的混合溶液中,加入少许CCl4,滴加少量X单质的水溶液,振荡,观察CCl4层的颜色,丙同学的设计依据是:在含有I-、Br-离子溶液中加入少量Cl2,还原性强的物质先被氧化,
故答案为:
| 序号 | 实验内容 | 实验现象 | 用离子方程式解释现象 |
| 实验Ⅰ | 橙红 | Cl2+2Br-=2Cl-+Br2. | |
| 实验Ⅱ | 紫红 | Br2+2I-=2Br-+I 2. |
点评 本题考查位置结构性质关系应用、元素周期律、元素非金属性探究实验,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| W | X | |
| Y | Z |
| A. | Z元素的氧化物对应水化物的酸性一定强于Y | |
| B. | X、Y、Z中最简单氢化物稳定性最弱的是Y | |
| C. | X元素的简单离子还原性大于Y | |
| D. | Z元素单质在化学反应中只表现氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO3- | B. | CO32-、NO3- | C. | SO32-、NO3- | D. | CO32-、NO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
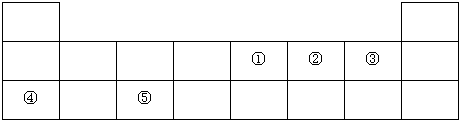
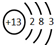 .
.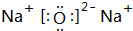 、
、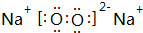 .(写两个)
.(写两个)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人类目前所直接利用的能量大部分是由化学反应产生的 | |
| B. | 煤、石油、天然气是当今世界最重要的三种化石燃料 | |
| C. | 化学变化中的能量变化主要是由化学键变化引起的 | |
| D. | 化学反应中能量变化的大小与反应物的质量多少无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
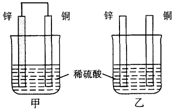
| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中硫酸溶液的浓度均下降 | D. | 产生气泡的速度甲比乙慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2在正极发生氧化反应 | |
| B. | 供电时的总反应是 2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$ 2H2O | |
| C. | 氢氧燃料电池中反应放出的热量转变为电能 | |
| D. | 产物是无污染的水,属于环境友好电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ②⑤⑥ | C. | ② | D. | ②⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com