
| A、③④①②⑤ |
| B、④③②⑤① |
| C、①③②④⑤ |
| D、④⑤②③① |


科目:高中化学 来源: 题型:
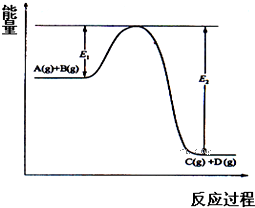 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题:
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在恒容的密闭容器中混合气体的密度不变 |
| B、在恒容的密闭容器中混合气体的压强不变 |
| C、A、B、C的浓度之比为1:2:1,且保持不变 |
| D、A的消耗速率与C的生成速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化钙溶液中通入少量二氧化碳:CaCl2+CO2+H2O=CaCO3↓+2HCl | ||||
B、铁在氯气中燃烧:Fe+Cl2
| ||||
| C、从煤油中取出的金属钠用小刀切割后,切割面变暗:4Na+O2=2Na2O | ||||
| D、少量的溴水与氯化钾溶液反应:Br2+2KCl=2KBr+Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤⑥⑦⑧ |
| B、①③⑤⑦⑧ |
| C、①③④⑤⑦ |
| D、全部都是 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将含有SO2的CO2气体通过足量的饱和Na2CO3溶液以除去SO2 |
| B、称取19.0g氯化亚锡(SnCl2),用100mL蒸馏水溶解,配制1.0mol/L SnCl2溶液 |
| C、用石墨作电极,电解Mg(NO3)2、Cu(NO3)2的混合溶液,确定铜和镁的金属活动性强弱 |
| D、测定NaCl和NaF溶液的pH值,确定F、Cl两元素非金属性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素B、C、D的最高价氧化物对应的水化物能相互反应 |
| B、原子半径:D>C>B |
| C、元素A、B、C的氧化物均为共价化合物 |
| D、单质的还原性:D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com