
分析 (1)小块金属钠露置于空气中发生的变化中,银白色$\stackrel{①}{→}$变灰暗$\stackrel{②}{→}$变白色$\stackrel{③}{→}$表面潮湿出现液滴$\stackrel{④}{→}$白色固体$\stackrel{⑤}{→}$形成白色粉末,可能发生的反应为①是钠被氧化为氧化钠;②是氧化钠和水反应生成氢氧化钠;③氢氧化钠潮解形成氢氧化钠溶液;④是二氧化碳和氢氧化钠反应生成碳酸钠固体,⑤碳酸钠固体变成碳酸钠粉末;
(2)A.无新物质的生成的变化为物理变化;
B.④是二氧化碳和氢氧化钠反应生成碳酸钠固体;
C.⑤碳酸钠固体变成碳酸钠粉末;
D.整个变化过程中只有钠被氧化为氧化钠为氧化还原反应.
解答 解:(1)Na的性质活泼,易与空气中氧气反应生成Na2O,Na2O易与水反应生成NaOH,NaOH吸收空气中的水和CO2生成Na2CO3•xH2O,Na2CO3•xH2O风化脱水生成Na2CO3,可能发生的反应的化学方程式为:①4Na+O2=2Na2O(银白色→变灰暗),Na2O+H2O=2NaOH(变灰暗→变白色),2NaOH+CO2+(x-1)H2O=Na2CO3•xH2O(表面潮湿出现液滴→白色固体),Na2CO3•xH2O=Na2CO3+xH2O(白色固体→形成白色粉末),
故答案为:Na2CO3,Na2O+H2O=2NaOH;
(2)A.③氢氧化钠潮解形成氢氧化钠溶液,无新物质生成,故A正确;
B.④是2NaOH+CO2+(x-1)H2O=Na2CO3•xH2O,不是碳酸钠吸收空气中的CO2、水蒸气,故B错误;
C.⑤是Na2CO3•xH2O=Na2CO3+xH2O(白色固体→形成白色粉末),故C正确;
D.有元素化合价变化的反应为氧化还原反应,整个变化过程中只有钠被氧化为氧化钠为氧化还原反应,故D正确;
故答案为:ACD.
点评 本题考查了钠及其化合物的性质,是高考的热点,题目难度不大,明确钠以及化合物的性质是解题关键.


 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 生成物全部化学键形成所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为吸热反应 | |
| B. | 向Na2CO3溶液中加少量BaCl2固体,CO32-的水解程度变小 | |
| C. | 在FeCl3+3KSCN?3KCl+Fe(SCN)3体系中加入KI固体,平衡不移动 | |
| D. | 对一个可逆反应来说,吸热反应一方的速率受温度变化的影响总是大于放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2 | B. | CO2 | C. | H2O2 | D. | NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
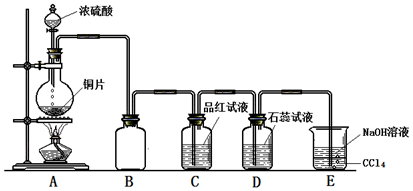
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(1)△H=-149.2 kJ/mol | B. | H2(g)+O2(g)═H2O(1)△H=+285.8 kJ/mol | ||
| C. | 2H2(g)+O2(g)═2H2O(g)△H=-571.6kJ/mol | D. | 2H2(g)+O2(g)═2H2O(1)△H=-571.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A+3B=2C | B. | 3A+B=2C | C. | A+B=C | D. | 2A+3B=2C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com