
| A. | 将同浓度的NaHA和Na2A溶液等体积混合,所得溶液的pH一定小于7 | |
| B. | 0.1 mol•L-1的NaHA溶液中离子浓度为:c(Na+))>c(HA-)>c(H+>c(A2-)>c(OH-) | |
| C. | 在0.1 mol•L-1的H2A溶液中,c(H+)>0.12 mol•L-1 | |
| D. | 在0.1 mol•L-1的Na2A溶液中,c(A2-)+c(HA-)+c(Na+)=0.3mol•L-1 |
分析 A.题中HA-?H++A2-(Ka2=1.0×10-2),电离平衡常数较大,同浓度(0.1mol•L-1)的NaHA和Na2A溶液等体积混合,其pH应小于7;
B.HA-只能电离不能水解,溶液呈酸性,氢氧根离子浓度较小,则c(H+)>c(A2-)>c(OH-);
C.二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-?H++A2-(Ka2=1.0×10-2),第一步完全电离,第二步部分电离,根据平衡常数计算溶液的c(H+);
D.任何电解质溶液中都存在物料守恒,根据物料守恒判断.
解答 解:A.由Ka2=1.0×10-2知,HA-的电离度为10%,在温度不变时,同浓度(0.1mol•L-1)的NaHA和Na2A溶液等体积混合,溶液中的c(H+)近似为0.01mol/L,变化不大,溶液仍呈酸性,溶液的pH小于7,故A正确;
B.0.1 mol•L-1的NaHA溶液中,HA-只能电离不能水解,则溶液呈酸性,则c(H+)>c(A2-)>c(OH-),溶液中离子浓度大小为:c(Na+))>c(HA-)>c(H+>c(A2-)>c(OH-),故B正确;
C.二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-=H++A2-(Ka2=1.0×10-2),第一步完全电离,第二步部分电离,设电离的HA-为x,则有:$\frac{(0.1+x)•x}{0.1-x}$=1.0×10-2,解得:x=0.0084.所以在0.1mol•L-1的H2A溶液中,c(H+)=0.1mol/L+0.0084mol/L=0.1084mol/L,故C错误;
D.二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-?H++A2-(Ka2=1.0×10-2),可知第一步完全电离,第二步部分电离,则在0.1mol•L-1的Na2A溶液中,存在HA-和A2-离子,且c(A2-)+c(HA-)=0.1mol•L-1,又c(Na+)=0.2mol•L-1,所以c(A2-)+c(HA-)+c(Na+)=0.3mol•L-1,故D正确;
故选C.
点评 本题考查离子浓度大小比较,题目难度中等,正确分析电离平衡特点为解答关键,注意掌握弱电解质的电离平衡及其影响,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
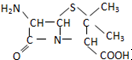 ) 是青霉素类抗生素的母核,与有机物F缩合生成阿莫西林.某同学用对甲基苯酚为原料设计阿莫西林的合成路线如图:
) 是青霉素类抗生素的母核,与有机物F缩合生成阿莫西林.某同学用对甲基苯酚为原料设计阿莫西林的合成路线如图: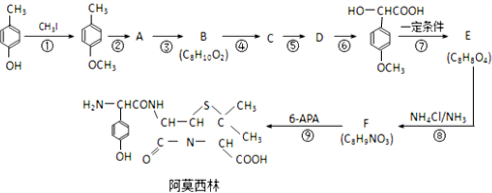
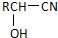 $\stackrel{H_{2}O/H+}{→}$
$\stackrel{H_{2}O/H+}{→}$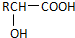
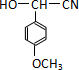 ;
;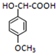 的一种同分异构体的一氯代物的结构为
的一种同分异构体的一氯代物的结构为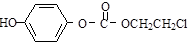 ,该物质在NaOH水溶液中加热反应反应时的化学方程式为
,该物质在NaOH水溶液中加热反应反应时的化学方程式为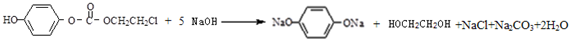 ;
;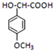 满足以下条件的同分异构体有3种.
满足以下条件的同分异构体有3种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
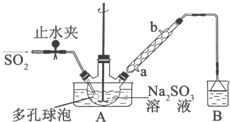 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解.在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解.在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
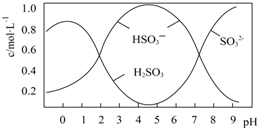 葡萄酒常用Na2S2O5做抗氧化剂.
葡萄酒常用Na2S2O5做抗氧化剂.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
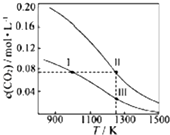 在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )| A. | 反应CO2(g)+C(s)?2CO(g)的△S>0、△H<0 | |
| B. | 体系的总压强P总:P总(状态Ⅱ)<2P总(状态Ⅰ) | |
| C. | 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) | |
| D. | 逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com