
在有机物分子中,不同氢原子的核磁共振谱中给出的信号也不同,根据信号可以确定有机物分子中氢原子的种类和数目。例如二乙醚的结构简式为: CH3—CH2—O—CH2—CH3 ,其核磁共振谱中给出的信号有两个,如图①所示:
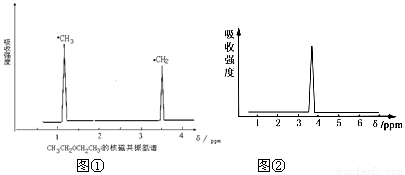
(1)下列物质中,其核磁共振氢谱中给出的信号只有一个的是 。(填序号)
A.CH3CH3 B. CH3COOH C. CH3OH D. CH3OCH3
(2)化合物A和B的分子式都是C2H4Br2, A的核磁共振氢谱图如右图②所示,则A的结构简式为 ,请预测B的核磁共振氢谱上有 种信号。
(3)在常温下测得的某烃C8H10(不能与溴水反应)的核磁共振谱上,观察到两种类型的H 原子给出的信号,其强度之比为2:3,试确定该烃的结构简式为 ;该烃在光照下生成的一氯代物在核磁共振谱中可产生 种信号,强度比为 。
(4)在常温下测定相对分子质量为128的某链烃的核磁共振谱,观察到两种类型的H原子给出的信号,其强度之比为9:1,则该烃的结构简式为 ,其名称为 。
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源:2016届吉林省高三上四次模拟化学卷(解析版) 题型:选择题
某无色稀溶液X中,可能含有如表所列离子中的某几种。
阴离子 | CO32- 、SiO32-、AlO2- 、Cl- |
阳离子 | Al3+、Fe3+、Mg2+、NH4+ 、Na+ |
取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示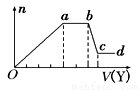 下列说法正确的是
下列说法正确的是
A.若Y是盐酸,则X中一定含有CO32-、SiO32-、AlO2-和Na+
B.若Y是NaOH溶液,则X中一定含有Al3+、Fe3+、NH4+、Cl-
C.若Y是NaOH溶液,则ab段发生反应的离子方程式为:NH4++OH-=NH3↑+H2O
D.若Y是NaOH溶液,则X中的Al3+、Mg2+、NH4+ 物质的量之比为1:1:2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西省高二上段考文化学试卷(解析版) 题型:选择题
某实验需要使用大约480mL 1mol/L的稀H2SO4,现若要你用18.4mol/L的浓H2SO4配制,则你需量取浓H2SO4的体积是
A.26.1mL B.27.2mL C.26.0m L D.27.0mL
查看答案和解析>>
科目:高中化学 来源:2015-2016年陕西西藏民族学院附属中学高二上期末化学卷(解析版) 题型:选择题
某同学按照课本实验要求,用50mL 0.50mol•L﹣1的盐酸与50mL 0.55mol•L﹣1的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应 过程中所放出的热量计算中和热.下列说法中,正确的是( )
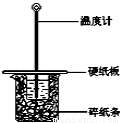
A.实验过程中没有热量损失
B.烧杯间填满碎纸条的作用是固定小烧杯
C.图中实验装置缺少环形玻璃搅拌棒
D.若烧杯上不盖硬纸板,测得的△H将偏小
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上期末考试化学试卷(解析版) 题型:实验题
Ⅰ、亚硝酸钠在漂白、电镀等方面应用广泛。现在木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如图所示(部分夹持装置略)。

已知:①3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O
②酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+;
完成下列填空:
(1)写出a仪器的名称__________________;
(2)为避免B中逸出的气体中混有的杂质气体与Na2O2反应,应在B、C装置间增加一个装置,则该装置中盛放的药品名称为__________________;
(3)写出NO与Na2O2在常温下生成NaNO2的化学反应方程式_________________;当该反应中转移0.1mole-时,理论上吸收标准状况下NO的体积为__________________ ;
(4)D装置中发生反应的离子方程式为__________________。
Ⅱ、焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:

实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5.装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2═Na2S2O5
(1)装置Ⅰ中产生气体的化学方程式为___________________;
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是_______________;
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹时仪器已略去)为____________(填序号);

实验二 葡萄酒中抗氧化剂残留量的测定
(4)葡萄酒常用Na2S2O5作抗氧化剂.测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O═H2SO4+2HI)
在上述实验过程中,若有部分HI被空气氧化,则测定结果__________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西柳州铁路一中高一上12月月考化学卷(解析版) 题型:推断题
置换反应的通式可用右图表示,单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:

(1)若单质甲是生活中用途最广泛的金属,单质乙是最轻的气体,则甲是 。
(2)若化合物A常温下呈液态,化合物B的焰色反应呈黄色,则该反应的离子反应方程式为 。
(3)工业上利用置换反应原理制备一种半导体材料,写出该反应的化学方程式 。
(4)若气体单质乙能在空气中燃烧,化合物B为黑色磁性晶体,写出该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上期末考试化学试卷(解析版) 题型:推断题
乙醇经下列步骤反应合成化合物C(分子式为C4H8O2),已知C是环状化合物且不能使溴水、KMnO4(H+)溶液褪色,反应路线如下:

(1)写出A.C结构简式:A , C ;
(2)写出x、y的反应类型:x 、y 。
查看答案和解析>>
科目:高中化学 来源:2016届河北省衡水市高三上一轮复习检测二化学试卷(解析版) 题型:填空题
I.氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的PH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;
Ⅱ.25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如右图(忽略溶液体积的变化、H2S的挥发)。

①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1.
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一上期末考试化学试卷(解析版) 题型:选择题
合金是一类用途广泛的金属材料。下列物质中,不属于合金的是 ( )
A.碳素钢 B.黄铜 C.硬铝 D.水银
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com