
【题目】常温下,关于pH = 2的盐酸,下列说法不正确的是
A. 溶液中c(H+)=1.0ⅹ10-2mol·L-1
B. 此溶液中由水电离出的c(OH-)=1.0ⅹ10-12mol·L-1
C. 加水稀释100倍后,溶液的pH=4
D. 加入等体积pH=12的氨水,溶液呈中性
科目:高中化学 来源: 题型:
【题目】如图所示,A为电源,B为浸透饱和食盐水和酚酞溶液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料及电解质溶液如图所示。
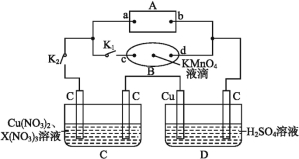
(1)关闭K1,打开K2,通电后,B的KMnO4紫红色液滴向c端移动,则电源b端为 极,通电一段时间后,滤纸d端的电极反应式是 。
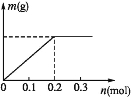
(2)已知C装置中溶液的溶质为Cu(NO3)2和X(NO3)3,且均为0.1 mol,打开K1,关闭K2,通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图所示,则Cu2+、X3+、H+氧化能力由大到小的顺序是 。
(3)D装置中溶液是H2SO4溶液,则电极C端从开始至一段时间后的实验现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选修5:有机化学基础】用甲苯合成有机高分子化合物 M 的流程如下。
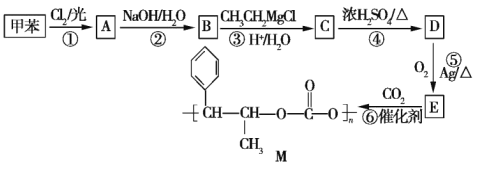
已知:Ⅰ.B 能发生银镜反应;
Ⅱ.同一个碳原子上连接两个羟基的结构不稳定,会自动脱去一个水分子变成羰基;
Ⅲ.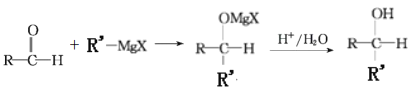 (R,R'均为烃基);
(R,R'均为烃基);
Ⅳ.E 的分子式为 C9H10O,其分子中含有1个三元环。
请回答下列问题。
(1)写出结构简式:A___________,D___________,E____________。
(2)写出反应类型:反应①__________________,反应⑥___________________。
(3)写出下列反应的化学方程式:反应④__________________。
B与新制的Cu(OH)2悬浊液共热反应_________________。
(4)A 的同分异构体中含有苯环的有___________种(不包括A自身),其中在核磁共振氢谱图中出现三组峰,且峰面积之比为 1∶1∶1 的是_____________(填结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究碳铁合金与浓硫酸在酸性条件下反应的部分产物并测定碳铁合金中铁元素的质量分数,某化学小组设计了下图所示的实验装置,并完成以下实验探究。


(1)往圆底烧瓶中加入m g铁碳合金,并滴入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:①常温下,Fe在浓硫酸中 ;②常温下,碳和浓硫酸不反应。
(2)装置B的作用是 。
(3)甲同学观察到装置C中有白色沉淀生成,他得出了使澄清石灰水变浑浊的气体是二氧化碳。装置A中能产生二氧化碳的化学方程式为 。
(4)乙同学认为甲同学的结论是错误的,他认为为了确认二氧化碳的存在,需在装置B-C之间添加装置M。装置E、F中盛放的试剂分别是酸性高锰酸钾、 。重新实验后观察到装置F中的现象是 。
(5)有些同学认为合金中铁元素的质量分数可用KMnO4溶液来测定。
(5Fe2++MnO4—+8H+==5Fe3++Mn2++4H2O)。
测定铁元素质量分数的实验步骤如下:
I.往烧瓶A中加入过量的还原剂铜使溶液中的Fe3+完全转化为Fe2+,过滤,得到滤液B;
II.将滤液B稀释为250 mL;
III.取稀释液25.00 mL,用浓度为c mol·L—1的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为V mL。
①步骤Ⅱ中,将滤液B稀释为250 mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须要用到的是 ;
②滴定过程中 (填“需要”或“不需要”)加入指示剂
③铁碳合金中铁元素的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的操作正确的是( )
实验 | 操作 | |
A. | 配制稀硫酸 | 先将浓硫酸加入烧杯中,后倒入蒸馏水 |
B. | 排水法收集KMnO4分解产生的O2 | 先熄灭酒精灯,后移出导管 |
C. | 浓盐酸与MnO2反应制备纯净Cl2 | 气体产物先通过浓硫酸,后通过饱和食盐水 |
D. | CCl4萃取碘水中的I2 | 先从分液漏斗下口放出有机层,后从上口倒出水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是

A. 31d和33d属于同种核素
B. 工业上常用电解法制备单质b和c
C. 气态氢化物的稳定性:a>d>e
D. a和b形成的化合物不可能含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学模拟工业制碘的方法,探究ClO![]() 和I
和I![]() 的反应规律。实验操作及现象如下:
的反应规律。实验操作及现象如下:
实验及试剂 | 编号 | 无色NaClO3 溶液用量 | 试管中 溶液颜色 | 淀粉KI 试纸颜色 |
| 1 | 0.05 mL | 浅黄色 | 无色 |
2 | 0.20 mL | 深黄色 | 无色 | |
3 | 0.25 mL | 浅黄色 | 蓝色 | |
4 | 0.30 mL | 无色 | 蓝色 |
(1)取实验2后的溶液,进行如下实验:
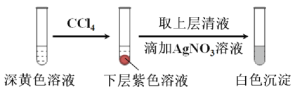
经检验,上述白色沉淀是AgCl。写出加入0.20 mL NaClO3后,溶液中ClO3-和I-发生反应的离子方程式: 。
(2)查阅资料:一定条件下,I-和I2都可以被氧化成IO3-。
作出假设: NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)中的反应产物继续反应,同时生成Cl2。
进行实验:
①取少量实验4中的无色溶液进行以下实验,进一步佐证其中含有IO3-。
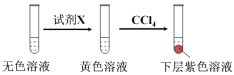
其中试剂X可以是 (填字母序号)。
a.碘水 b.MnO4溶液 c.NaHSO3溶液
② 有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2,便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30 mL 1.33 mol·L1 NaClO3溶液后,发现湿润的淀粉试纸没有明显变化。进行以上对比实验的目的是 ,进一步佐证实验4中生成了Cl2。
获得结论:NaClO3溶液用量增加导致溶液褪色的原因是 (用离子方程式表示)。
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如下实验结果:
编号 | 6.0 mol·L1 H2SO4溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
5 | 0.25 mL | 浅黄色 | 无色 |
6 | 0.85 mL | 无色 | 蓝色 |
①对比实验4和5,可以获得的结论是 。
②用离子方程式解释实验6的现象: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关混合物、纯净物、电解质、非电解质的正确组合为( )
纯净物 | 混合物 | 电解质 | 非电解质 | |
A. | 纯盐酸 | 水煤气 | 硫酸 | 干冰 |
B. | 蒸馏水 | 蔗糖溶液 | 氧化铝 | 二氧化硫 |
C. | 胆矾 | 氢氧化铁胶体 | 铁 | 碳酸钙 |
D. | 水银 | 澄清石灰水 | 氯化铜 | 碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.室温下,21.0 g乙烯气体中含有的碳原子数目为1.5NA
B.1 L 0.l mol/L的Na2CO3溶液中含有的CO![]() 数目为0.1NA
数目为0.1NA
C.标准状况下,11.2 L CH3CH2OH中含有分子的数目为0.5NA
D.在密闭容器中加入1. 5 mol H2和0.5 mol N2,充分反应后NH3的分子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com