
| A. | pH=1的溶液中:NH4+、Na+、Fe3+、SO42- | |
| B. | 含有大量AlO2-的溶液中:Na+、K+、HCO3-、NO3- | |
| C. | 中性溶液中:K+、Fe3+、Cl-、SO42- | |
| D. | Na2S溶液中:SO42-、K+、Cu2+、Cl- |
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:解答题

 $→_{Zn/H_{2}O}^{O_{3}}$
$→_{Zn/H_{2}O}^{O_{3}}$ +
+
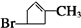 、E
、E .
.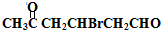 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$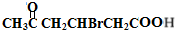 +Cu2O↓+2H2O.
+Cu2O↓+2H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y2分子中,σ键和π键数目之比为2:1 | |
| B. | Z单质与W单质发生反应,产物只有一种 | |
| C. | 元素X、Z形成的化合物中仅含极性共价键 | |
| D. | 只含X、Y、Z三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铜为电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 金属铝的冶炼:2AlCl3(熔融)$\frac{\underline{\;通电\;}}{\;}$2Al+3Cl2↑ | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+ | |
| D. | 碱性氢氧燃料电池的正极反应为:O2+4e-+2H2O═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
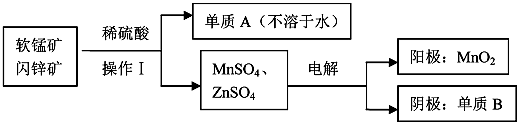
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一种物质被氧化,必有另一种物质被还原 | |
| B. | CO2的水溶液可以导电,所以CO2是电解质 | |
| C. | Na2O2可用作呼吸面具中的供氧剂 | |
| D. | 四氧化三铁俗称铁红,可用于作油漆、红色涂料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com