
下列解释事实的方程式不正确的是( )
A.用浓盐酸检验氨:NH3+HCl=NH4Cl
B.碳酸钠溶液显碱性:CO32—+H2O HCO3—+OH-
HCO3—+OH-
C.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+
D.长期盛放石灰水的试剂瓶内壁出现白色固体:Ca(OH)2+CO2=CaCO3↓+H2O
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源:2013-2014学年高考化学二轮复习提分训练 专题4物质结构元素周期律练习卷(解析版) 题型:填空题
部分中学化学常见元素原子结构及性质如表所示:
序号元素结构及性质
①AA单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5
②BB原子最外层电子数是内层电子总数的
③CC是常见化肥的主要元素,单质常温下呈气态
④DD单质被誉为“信息革命的催化剂”,是常用的半导体材料
⑤E通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物
⑥FF在周期表中可以排在ⅠA族,也有人提出排在ⅦA族
(1)A原子在周期表中的位置为________。
(2)B与C形成的化合物的化学式为________,它属于________化合物(填“离子”或“共价”)。
(3)F与E可以形成10电子和18电子的两种化合物X和Y,区别X与Y的水溶液的实验方法是_______________________________________。
(4)C与E都是较活泼的非金属元素,用化学方程式表明这两种单质的氧化性强弱__________________________________________________________。
(5)列举一个实验事实证明A、B两种元素单质还原性的强弱_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习提分训练 专题10金属元素及其化合物练习卷(解析版) 题型:选择题
下列物质的转化在给定条件下能实现的是( )。

A.①③⑤ B.②③④ C.②④⑤ D.①④⑤
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 离子反应、氧化还原反应练习卷(解析版) 题型:填空题
某溶液可能含有Na+、K+、Mg2+、Cu2+等阳离子及MnO4—、SiO32—、AlO2—、CO32—、HCO3—、SO42—、Cl-等阴离子,已知:①该溶液呈无色;②经测定溶液的pH=12;③取少量溶液,加入100 mL 2 mol·L-1稀盐酸进行酸化,有白色沉淀生成,还得到一种无色无味的气体,该气体使澄清石灰水(足量)变浑浊。对酸化后的溶液过滤,得到滤液甲。
(1)由①②③可判断:原溶液中一定不存在的离子是________,一定存在的离子是________。
(2)将滤液甲分成两等份,一份中逐滴加入氨水、最终有白色胶状沉淀,说明原溶液中一定有________(填离子符号),刚开始加入氨水时,没有沉淀产生,原因是____________________________________(用离子方程式表示);另一份中加入足量的Ba(NO3)2溶液,有白色沉淀生成,说明原溶液中一定有________(填离子符号),过滤得到滤液乙。
(3)往滤液乙中加入足量的AgNO3溶液,过滤、洗涤、干燥得固体26.5 g,则原溶液中是否有Cl-?________(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 离子反应、氧化还原反应练习卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是( )
①硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42—=BaSO4↓
②将金属钠加入水中:2Na+2H2O=2Na++2OH-+H2↑
③石灰石溶于稀醋酸:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O
④氯气与水反应:Cl2+H2O=H++Cl-+HClO
⑤小苏打溶液中加入少量石灰水:Ca2++2OH-+2HCO3—=CaCO3↓+CO32—+2H2O
⑥次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
⑦钠与硫酸铜溶液反应:Cu2++2Na=Cu+2Na+
⑧纯碱溶液中滴加少量盐酸:CO32—+H+=HCO3—
A.①②⑤ B.②③④⑤⑧ C.④⑤⑥⑦ D.②③⑧
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 电解质溶液练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.反应2Mg+CO2 2MgO+C ΔH<0从熵变角度看,可以自发进行
2MgO+C ΔH<0从熵变角度看,可以自发进行
B.在密闭容器发生可逆反应:2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小
N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小
C.已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积的浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度均为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生
D.根据HClO的Ka=3.0×10-8,H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者小于后者
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 电解质溶液练习卷(解析版) 题型:选择题
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判断不正确的是( )
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)= mol/L
mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 物质结构与性质练习卷(解析版) 题型:填空题
A、B、C、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期元素,F为第四周期元素,F还是前四周期中电负极最小的元素。
已知:
A原子的核外电子数与电子层数相等;
B元素原子的核外p电子数比s电子数少1个;
C原子的第一至第四电离能为I1=738 kJ/mol,I2=1451 kJ/mol,I3=7733 kJ/mol,I4=10540 kJ/mol;
D原子核外所有p轨道为全充满或半充满;
E元素的族序数与周期序数的差为4;
(1)写出E元素在周期表位置:________;D元素的原子的核外电子排布式:____________________。
(2)某同学根据题目信息和掌握的知识分析C的核外电子排布为
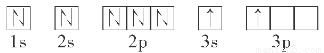
该同学所画的轨道式违背了________。

(3)已知BA5为离子化合物,写出其电子式:______________。
(4)DE3中心原子杂化方式为__________________,其空间构型为______________。
(5)某金属晶体中原子堆积方式如图甲,晶胞特征如图乙,原子相对位置关系如图丙,则晶胞中该原子配位数为________;空间利用率为________;该晶体的密度为________。(已知该金属相对原子质量为m,原子半径为a cm)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 物质的组成性质分类及化学用语练习卷(解析版) 题型:选择题
下列有关物质性质的描述和该性质的应用均正确的是( )
A.氨气具有氧化性,用浓氨水检验氯气管道是否泄漏
B.氢氟酸具有强酸性,用氢氟酸蚀刻玻璃
C.二氧化硫具有还原性,用二氧化硫水溶液吸收溴蒸气
D.铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com