
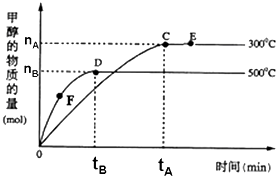
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g)?CH3OH(g),根据题意,以下说法正确的是( )
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g)?CH3OH(g),根据题意,以下说法正确的是( )| A. | 正反应的△H<0 | |
| B. | 容器中气体的总物质的量E点大于D点 | |
| C. | F点的正反应速率大于逆反应速率 | |
| D. | v(甲醇)=$\frac{{n}_{B}}{3{t}_{B}}$mol/(L•min)表示500℃时反应在D点的速率 |
分析 A.根据温度对甲醇质量的影响判断平衡移动方向,可判断正反应的△H;
B.根据温度对甲醇质量的影响判断平衡移动方向,可判断气体的总物质的量大小;
C.根据F点时反应向正反应方向移动分析;
D.根据v=$\frac{△c}{△t}$计算的反应速率是指在0到tB内的平均反应速率.
解答 解:A.从图象可知温度高时平衡体系中甲醇含量减少,平衡向逆反应方向移动,所以正反应的△H<0,故A正确;
B.从图象可知温度高时平衡体系中甲醇含量减少,平衡向逆反应方向移动,所以温度越高,气体的总物质的量越大,故D点大于E点,故B错误;
C.由图象分析,F点时反应向正反应方向移动,所以正反应速率大于逆反应速率,故C正确;
D.500℃时,反应开始到平衡,v(甲醇)=$\frac{△c}{△t}$=$\frac{{n}_{B}}{3{t}_{B}}$mol/(L•min)表示0到tB内甲醇的平均反应速率,故D错误.
故选AC.
点评 本题考查化学平衡移动图象问题,题目难度中等,解答该题的关键是把握图象的曲线变化特点,以此判断温度对平衡移动的影响,注意平衡移动原理,很多题目以填空题的形式考查.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:选择题
 中国最新战机歼-31使用了高强度、耐高温的钛合金材料.工业上冶炼钛的反应如下:
中国最新战机歼-31使用了高强度、耐高温的钛合金材料.工业上冶炼钛的反应如下:| A. | TiCl4是还原剂 | B. | Mg被氧化 | ||
| C. | TiCl4发生氧化反应 | D. | Mg得到电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| b的范围 | 溶质的种类 | 溶质的物质的量(mol) |
| 0.5 | NaHSO3 | 0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热蒸干并灼烧FeCl3溶液,得到Fe2O3固体 | |
| B. | 铁在潮湿的环境下生锈 | |
| C. | 明矾净水 | |
| D. | 浓硫化钠溶液有臭味 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
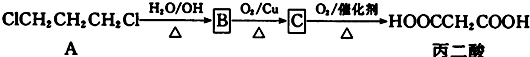

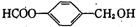 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是酸性氧化物,能与NaOH溶液反应 | |
| B. | NH3的水溶液能导电,说明NH3是电解质 | |
| C. | SO2能使溴水褪色,表现了漂白性 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 哈伯因为氨气的合成曾获1918年诺贝尔奖.
哈伯因为氨气的合成曾获1918年诺贝尔奖.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com