
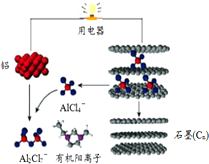
 斯坦福大学华人化学家戴宏杰率领的团队研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
斯坦福大学华人化学家戴宏杰率领的团队研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 充电时,该电池负极应连接外接电源的负极 | |
| B. | 放电时,电子从铝流出经过电解质溶液到达石墨电极 | |
| C. | 充电时的阳极反应为:Cn+AlCl4--e-═CnAlCl4 | |
| D. | 放电时的负极反应为:Al-3e-+7AlCl4-═4Al2Cl7- |
分析 由示意图可知放电时铝为负极,被氧化生成Al2Cl7-,电极方程式为Al+7AlCl4--3e-═4Al2Cl7-,正极反应为3Cn[AlCl4]+3e-=3Cn+3AlCl4-,电解时阳极发生氧化反应,电解方程式为Cn+AlCl4--e-═Cn[AlCl4],阴极发生还原反应,电极方程式为4Al2Cl7-+3e-=Al+7AlCl4-,以此解答该题.
解答 解:A.充电时,原电池负极(阴极)应连接外接电源的负极,故A正确;
B.放电时,铝是活泼的金属铝是负极,不活泼石墨为正极,电子由负极经导线流向正极,电子不能再电解质溶液中流动,故B错误;
C.充电时,阳极发生氧化反应,电极反应式为:Cn+AlCl4--e-═Cn[AlCl4],故C正确;
D.放电时负极发生氧化反应生成铝离子,铝离子与AlCl4-结合生成Al2Cl7-,所以电极反应式为:Al-3e-+7AlCl4-═4Al2Cl7-,故D正确;
故选B.
点评 本题考查学生二次电池的工作原理以及原电池和电解池的工作原理知识,为高频考点,侧重学生的分析能力的考查,属于综合知识的考查,难度中等,注意把握电极的判断方法和电极方程式的书写.


科目:高中化学 来源: 题型:实验题
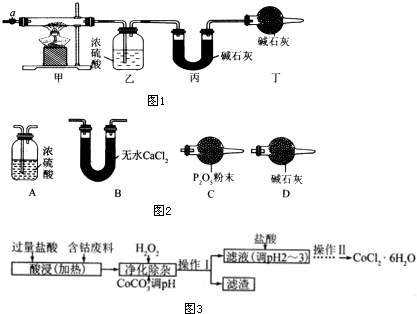
| 乙装置的质量/g | 丙装置的质量/g | |
| 加热前 | 80.00 | 62.00 |
| 加热后 | 80.36 | 62.88 |
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H3PO4 | D. | 熔点:NaCl>Na>CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:| 滴定次数 | 盐酸体积(ml) | NaOH溶液体积读数(ml) | |
| 滴定前 | 滴定后 | ||
| 20.00 | 0.00 | 16.30 | |
| 2 | 20.00 | 0.00 | 16.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 相对分 子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
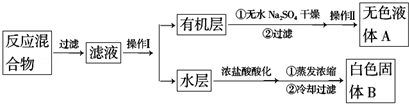
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某温度下,1L pH=8的纯水中含OH-为10 -6mol | |
| B. | 电解精炼铜过程中,阳极质量的减少值与阴极质量的增加值一定相等 | |
| C. | 合成氨的反应是放热反应,则采用低温条件可以提高氨的生成速率 | |
| D. | CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(O{H}^{-})}$的值减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com