
【题目】化学与生产、生活、社会密切相关,下列说法正确的是
A.利用海水制取氯化钠、烧碱、纯碱、氯气等物质都发生了氧化还原反应
B.蛋白质、葡萄糖、纤维素、油脂等都能在人体内水解并提供能量
C.为了提高生活用水的卫生标准,自来水厂常使用![]() 和
和![]() 进行消毒、净化、以改善水质
进行消毒、净化、以改善水质
D.塑料、合成橡胶和纤维这三大合成材料,都主要以石油、煤和天然气为原料生产的
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】新型陶瓷材料氮化硅(Si3N4)可用于制作火箭发动机中燃料的喷嘴。氮化硅可由石英、焦炭在高温氮气流中制取。完成下列填空:______SiO2+______C+______N2![]() ______Si3N4+______CO。
______Si3N4+______CO。
(1)试配平该化学反应方程式,将系数填写在对应位置上。在方程式上标出电子转移的方向和数目。____________
(2)反应中______被还原,当氧化产物比还原产物多 1mol 时,反应中电子转移数为______。
(3)在该反应体系中:所涉及物质属于非极性分子的电子式为______;所涉及元素中原子半径最大的原子的最外层电子排布式为______。
(4)反应的主要产物氮化硅所属的晶体类型为______,证明氮化硅组成元素非金属性强弱:
(Ⅰ)写出一个化学事实______;
(Ⅱ)从原子结构上进行说明:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:2H2(g)+O2(g) ![]() 2H2O(l) H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g)
2H2O(l) H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g) ![]() 2CO2(g)+4H2O(l) H= -1452 kJ·mol-1,H+(aq)+OH-(aq)
2CO2(g)+4H2O(l) H= -1452 kJ·mol-1,H+(aq)+OH-(aq) ![]() H2O(l) H= -57.3 kJ·mol-1。据此判断下列说法正确的是
H2O(l) H= -57.3 kJ·mol-1。据此判断下列说法正确的是
A. CH3OH的燃烧热为1452 kJ·mol-1
B. 2H2(g)+O2(g) ![]() 2H2O(g) H > -571.6 kJ·mol-1
2H2O(g) H > -571.6 kJ·mol-1
C. CH3COOH(aq)+NaOH(aq) ![]() H2O(l)+CH3COONa(aq) H= -57.3 kJ·mol-1
H2O(l)+CH3COONa(aq) H= -57.3 kJ·mol-1
D. 2CH3OH(l)+O2(g) ![]() 2CO2(g)+4H2(g) H= -880.4 kJ·mol-1
2CO2(g)+4H2(g) H= -880.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为探究![]() 溶液和不同类型盐溶液反应的多样性,设计如图实验:
溶液和不同类型盐溶液反应的多样性,设计如图实验:
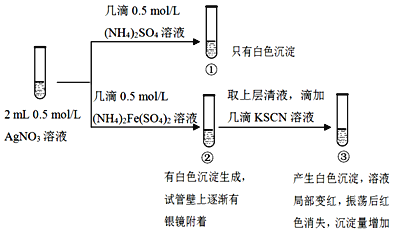
已知:AgSCN为白色难溶物。
下列说法不正确的是( )
A.①中的白色沉淀是![]()
B.向①的试管中滴加![]() KI溶液,有黄色沉淀生成证明存在
KI溶液,有黄色沉淀生成证明存在![]()
C.②中发生了氧化还原反应
D.对于③中红色褪去的原因可能与平衡移动原理有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含少量铁的氧化铜制取氯化铜晶体(CuCl2xH2O)。有如下操作:
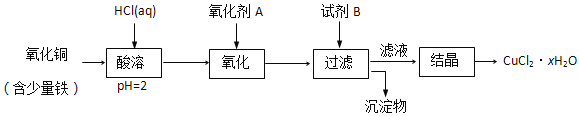
已知:在pH为4~5时,Fe3+几乎完全转化为Fe(OH)3沉淀,Cu2+却不反应。
①加热酸溶过程中发生反应的化学方程式有:__。
②氧化剂A可选用___(填编号,下同)。
A.KMnO4 B.HNO3 C.Cl2
③要得到较纯的产品,试剂B可选用___。
A.NaOH B.CuO C.FeO
④试剂B的作用是___。
A.使Cu2+完全沉淀 B.使Fe3+完全沉淀 C.降低溶液的pH D.提高溶液的pH
⑤从滤液经过结晶得到氯化铜晶体的方法是__(按实验先后顺序选填编号)。
A.过滤 B.蒸发至干 C.冷却 D.蒸发浓缩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在指定条件下能实现的是
①Cu![]() Cu2(OH)2CO3
Cu2(OH)2CO3![]() CuO
CuO
②CaCl2(aq) ![]() CaCO3
CaCO3![]() CaSiO3
CaSiO3
③MgO![]() MgCl2(aq)
MgCl2(aq) ![]() MgCl2(s)
MgCl2(s)
④N2![]() NO2
NO2![]() HNO3
HNO3
⑤Cl2![]() NaClO
NaClO![]() Cl2
Cl2
A.①④⑤B.①②⑤C.②③⑤D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下的方案。
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/ molL-1 | 体积/mL | 浓度/ molL-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,每消耗1mol H2C2O4转移_____mol 电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:c(H2C2O4)∶c(KMnO4) ≥______________。
(2)探究温度对化学反应速率影响的实验编号是___________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是_____________。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=_______________ molL-1min-1。
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在答题卡坐标图中,画出25℃时c(MnO4-)~t的变化曲线示意图。
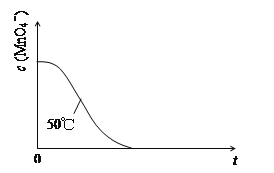 _____________
_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)氮、氧元素非金属性较强的是_____。(用元素符号回答)
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图1所示:

①由图1可知SCR技术中的氧化剂为:_________________。
②用Fe做催化剂时,在氨气足量的情况下,不同c(NO)/c(NO2)对应的脱氮率如图2所示,效果最佳的c(NO)/ c(NO2)=_________。
(3)硝酸厂常用如下烧碱吸收法处理氦氧化物(NO与NO2)尾气。氮氧化物(NO与NO2)用烧碱进行吸收,产物为NaNO2、NaNO3和H2O。现有含0.5mol氮氧化物的尾气,恰好被一定体积的25%NaOH溶液(密度1.28g/cm3)完全吸收。已知反应后溶液中含有0.35mo1NaNO2。则尾气中NO与NO2的物质的量之比为______。(已知:2NO2+2NaOH=NaNO3+NaNO2+H2O、NO+NO2+2NaOH=2NaNO2+H2O)
(4)现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的稀硝酸[假设反应中稀硝酸的还原产物只有NO),产生气体在标准状况下的体积与剩余固体的质量如下表:
硝酸体枳(mL) | 100 | 200 | 300 | 400 |
剩余固体(g) | 18.0 | 9.6 | 0 | 0 |
放出气体的体积(mL) | 2240 | 4480 | 6720 |
计算原混合物中铁和铜的物质的量比为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,难溶电解质的饱和溶液中存在沉淀溶解平衡,己知:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
KSP(25℃) | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
25℃时,对于CuSO4、FeSO4、Fe2(SO4)3各0.5mol的1L混合溶液,根据上表数据断,下列说法不正确的是( )
A. 向混合溶液中加入适量氨水,并调节pH在3~4后过滤,可获得纯净的CuSO4溶液
B. 向混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
C. 该溶液中c(SO42-):[c(Cu2+)+ c(Fe2+)+c(Fe3+)]>5:4
D. 在pH=5的溶液中.Fe3+不能大量存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com