
【题目】下列离子方程式与所述事实相符且正确的是
A.铁粉与过量稀盐酸反应:2Fe+6H+![]() 2Fe3++3H2↑
2Fe3++3H2↑
B.用Ca(OH)2与NH4Cl固体混合共热制取少量氨气:OH-+NH4+![]() NH3↑+H2O
NH3↑+H2O
C.铝与NaOH溶液反应:Al+2OH-= AlO2-+ H2↑
D.NO2溶于水:3NO2+H2O![]() 2H++ 2NO3-+ NO
2H++ 2NO3-+ NO
科目:高中化学 来源: 题型:
【题目】近年来甲醇用途日益广泛,工业上甲醇的合成途径多种多样。现有实验室中模拟甲醇合成反应,在2L密闭刚性的容器内,加入物质的量之比为![]() 的
的![]() 和
和![]() ,400℃时反应:
,400℃时反应:![]()
体系中![]() 随时间的变化如下表:
随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 5 |
| 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
(1)用![]() 表示从0~2s内该反应的平均速率
表示从0~2s内该反应的平均速率![]() _______________。
_______________。
(2)能说明该反应已达到平衡状态的是_______________。
a.![]() b.容器内压强保持不变
b.容器内压强保持不变
c.![]() d.容器内密度保持不变
d.容器内密度保持不变
(3)达到平衡时,甲醇在平衡体系中的体积分数为__________(保留小数点后一位)。
(4)![]() 与
与![]() 的反应可将化学能转化为电能,若用硫酸做电解质溶液形成原电池,
的反应可将化学能转化为电能,若用硫酸做电解质溶液形成原电池,![]() 应通入电池的_________极(“正”、“负”),且正极的电极反应式为_____________。
应通入电池的_________极(“正”、“负”),且正极的电极反应式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。
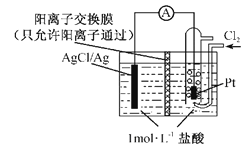
①正极反应为_________。
②当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少______mol离子。
(2)最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。示意图如图所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:
①EDTA-Fe2+-e-=EDTA-Fe3+
②2EDTA-Fe3++H2S=2H++S+2EDTA-Fe2+
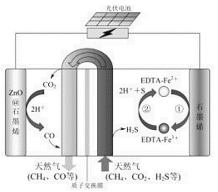
该装置工作时,阴极的电极反应:_________;协同转化总反应:___________;若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,溶液需为_______性(碱性、中性、酸性)
(3)以石墨为电极,电解Pb(NO3)2溶液制备PbO2,若电解过程中以铅蓄电池为电源,当电解装置中阳极增重23.9g时(忽略副反应),理论上蓄电池正极极增重______g。
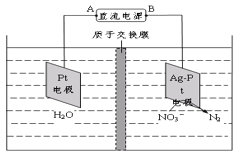
(4)电化学降解法可用于处理酸性硝酸盐污水,设计一电解池(如图所示)。 若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种具有高能量比的新型干电池示意图如图所示,石墨电极区发生的电极反应为MnO2+e-+H2O=MnO(OH)+OH-。该装置工作时,下列叙述正确的是
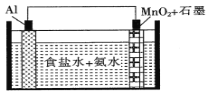
A. 石墨电极上的电势比Al电极上的低
B. Al电极区的电极反应式:A1-3e-+3NH3·H2O=Al(OH)3+3NH4+
C. 每消耗27gAl,有3mol电子通过溶液转移到石墨电极上
D. 若采用食盐水+NaOH溶液作电解质溶液,电极反应式相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g) ![]() S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示,下列说法正确的是
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示,下列说法正确的是
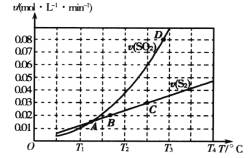
A. 该反应的H>0B. C点时达到平衡状态
C. 增加C的量能够增大SO2的转化率D. T3时增大压强,能增大活化分子百分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四甲基氢氧化铵[(CH3)4NOH]是强碱,常温下甲胺(CH3NH2·H2O)的电离常数为Kb,且pKb=-lgKb =3.38。常温下,在体积均为20mL、浓度均为0.1mol·L-1的四甲基氢氧化铵溶液和甲胺溶液,分别滴加浓度为0.1mol·L-1的盐酸,溶液的导电率与盐酸体积的关系如图所示。下列说法正确的是
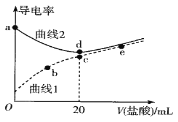
A. 曲线1代表四甲基氢氧化铵溶液
B. 在b、c、e三点中,水的电离程度最大的点是e
C. b点溶液中:c(Cl-)=c(CH3NH3+)+c(CH3NH2·H2O)
D. 常温下,CH3NH3Cl水解常数的数量级为10-11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2R为二元弱酸,向一定体积的0.1mol/L的H2R溶液中逐滴加入一定浓度的NaOH溶液,溶液中不同形态的粒子(H2R、HR-、R2-)的物质的量分数a(X)随pH的变化曲线如图所示[a(X)=c(X)/[c(H2R)+c(HR-)+c(R2-)]]。下列说法错误的是
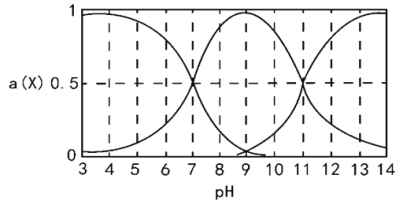
A. 常温下,K2(H2R)=1.0×10-11
B. 常温下,HR-在水中的电离程度大于其水解程度
C. pH=9时, c(Na+)>c(HR-)+2c(R2-)
D. pH=7时,c(H2R)=c(HR-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)是一种新兴化工原料,具有甲基化反应性能。
I.二甲醚的生产:二甲醚的生产原理之一是利用甲醇脱水成二甲醚,化学方程式如下:
反应i 2CH3OH(g) ![]() CH3OCH3(g) + H2O(g) ΔH 1
CH3OCH3(g) + H2O(g) ΔH 1
(1)已知:甲醇、二甲醚的气态标准燃烧热分别为-761.5 kJ·mol-1、-1455.2 kJ·mol-1,且H2O(g) = H2O(l) ΔH=﹣44.0 kJ·mol﹣1。则反应i的ΔH 1=_________kJ·mol﹣1.
(2)反应i中甲醇转化率、二甲醚选择性的百分率与不同催化剂的关系如下表所示,生产时,选择的最佳催化剂是_________。
催化剂 | 甲醇转化率/% | 二甲醚选择性/% |
SiO2-TiO2/SO42- | 35.1 | 98.1 |
SiO2-TiO2/Fe3+ | 52.9 | 98.7 |
GSAL-108 | 81.0 | 98.1 |
SiO2-Al2O3 | 62.1 | 96.4 |
注:反应条件:常压、温度270℃,甲醇液体空速14mL/(g·h)
(3)选定催化剂后,测得平衡时的甲醇转化率与温度的关系如图所示。经研究产物的典型色谱图发现该过程主要存在的副反应为:
反应ii 2CH3OH(g) ![]() C2H4 (g)+2H2O(g) ΔH2=﹣29.1kJ·mol﹣1
C2H4 (g)+2H2O(g) ΔH2=﹣29.1kJ·mol﹣1
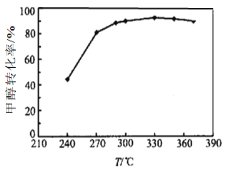
① 工业上生产二甲醚的温度通常在270-300℃,高于330℃之后,甲醇转化率下降。
根据化学平衡移动原理分析其原因可能是_________;
根据化学反应速率变化分析其原因可能是_________。
② 某温度下,以CH3OH(g)为原料,平衡时各物质的分压数据如下表:
物质 | CH3OH(g) | CH3OCH3(g) | C2H4 (g) | H2O(g) |
分压/MPa | 0.16 | 0.288 | 0.016 | … |
则反应i中,CH3OH(g)的平衡转化率α=_________。(用平衡分压代替平衡浓度计算;结果保留两位有效数字。)
II.二甲醚的应用:
(4)下图为绿色电源“直接二甲醚燃料电池”的工作原理示意图。该电池的负极反应式为:_________;
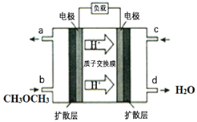
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列文字表述与反应方程式对应且正确的是( )
A. 乙醇与溴化氢的水溶液共热:CH3CH2OH+HBr![]() CH3CH2Br+H2O
CH3CH2Br+H2O
B. 甲烷和氯气在光照条件下的反应:2CH4+Cl2![]() 2CH3Cl+H2
2CH3Cl+H2
C. 苯酚溶液中滴入NaOH溶液:H++ OH-![]() H2O
H2O
D. 苯酚钠溶液中通入少量CO2:CO2+ H2O + 2C6H5O-![]() 2C6H5OH + 2CO32—
2C6H5OH + 2CO32—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com