
| 元素代号 | X | W | Y | Z | Q |
| 原子半径(×10-12m) | 37 | 71 | 74 | 77 | 186 |
| 主要化合价 | +1 | -1 | -2 | +4、-4 | +1 |
| A. | X和Q都属于金属元素 | |
| B. | Y和Z的基态原子s能级和p能级电子数相同 | |
| C. | Y和W的第一电离能大小比较:Y>W | |
| D. | X、Z形成的化合物分子中可能既有σ键又有π键 |
分析 原子的电子层数越大,其原子半径越大,同一周期元素中,原子半径随着原子序数增大而减小,在短周期元素中,元素的最高正化合价与其族序数相等,最低负化合价=族序数-8,
根据表中数据知,X的原子半径最小,且其正化合价为+1,则X位于第IA族;W、Y、Z为同周期元素,根据其化合价知,W为第VIIA族、Y为第VIA族、Z为第ⅣA族元素,Q为第IA族元素,其原子半径最大,且为短周期元素,所以Q是Na元素,W、Y、Z都属于第二周期元素,所以W是F元素、Y是O元素、Z是C元素,X原子半径小于W,所以X是H元素,再结合物质的结构分析解答.
解答 解:原子的电子层数越大,其原子半径越大,同一周期元素中,原子半径随着原子序数增大而减小,在短周期元素中,元素的最高正化合价与其族序数相等,最低负化合价=族序数-8,根据表中数据知,X的原子半径最小,且其正化合价为+1,则X位于第IA族;W、Y、Z为同周期元素,根据其化合价知,W为第VIIA族、Y为第VIA族、Z为第ⅣA族元素,Q为第IA族元素,其原子半径最大,且为短周期元素,所以Q是Na元素,W、Y、Z都属于第二周期元素,所以W是F元素、Y是O元素、Z是C元素,X原子半径小于W,所以X是H元素,
A.由以上分析可知X为H元素,为非金属,故A错误;
B.O和C的基态p能级电子数不同,分别为4和2,故B错误;
C.同周期元素从左到右元素的第一电离能逐渐增大,O<F,故C错误;
D.C、H形成的化合物如为乙烯、乙炔等,则既有σ键又有π键,故D正确.
故选D.
点评 本题考查了原子结构和元素周期律的关系,为高频考点,根据元素的原子半径、化合价结合元素周期律来推断元素,正确推断元素是解本题关键,再结合物质的结构来分析解答,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
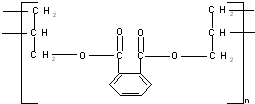
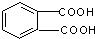 ⑤邻苯二甲酸甲酯
⑤邻苯二甲酸甲酯 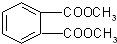
| A. | ①② | B. | ③④ | C. | ②④ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用pH试纸测定浓硫酸的pH | |
| B. | 向碘酒中加入CCl4,静置后分液,可以分离碘酒中的碘 | |
| C. | 用甲图装置验证FeCl3对H2O2分解反应有催化作用 | |
| D. | 用乙图装置验证NaHCO3和Na2CO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的简单离子半径小于W的简单离子半径 | |
| B. | W、X形成的化合物为离子化合物 | |
| C. | X的最高价氧化物对应的水化物的酸性比W的强 | |
| D. | Z的气态简单氢化物的稳定性比X的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液. | |
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+; 若无明显变化,则说明不含Fe2+. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铜作电极电解饱和食盐水,当线路中通过NA个电子时,阳极生成11.2L气体(标准状况下) | |
| B. | 把5.6g铁片投入到足量的冷的浓硝酸中,转移电子数为0.3NA | |
| C. | 12g石墨晶体中含有碳碳单键数为1.5NA | |
| D. | 15g-CH3中含有的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
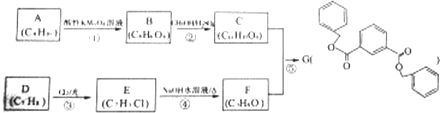
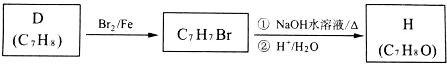
 .
.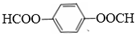 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com