
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
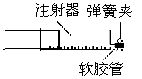
用示意图中的简易装置可以进行气体的发生和收集。
(1)实验前应如何检查该装置的气密性?
(2)拔开试管a的橡皮塞,加入10mL6mol/L稀硝酸和1g薄铜片,立即将带有导管的橡皮塞塞紧试管口。反应开始时速度缓慢,然后逐渐加快。请写出在试管a中发生的所有反应的化学方程式。
(3)从反应开始到反应结束,在试管a中可观察到哪些现象?请依次写出。
(4)在反应开始时,可观察到导管b中的水面先沿管b慢慢上升到一定高度,此后又回落,然后有气泡从管口冒出.试说明反应开始时,导管中水面先上升的原因。
(5)试管c收集满气体后,用拇指堵住管口,取出水槽.将管口向上,松开拇指,片刻后,再次堵住管口,将试管又再倒置于水槽中,松开拇指。此时可观察到什么现象?

查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省上杭一中高二下学期期末考试化学试卷(带解析) 题型:实验题
(6分,每空格2分)维生素C(又名抗坏血酸,分子式为C6H8O6)具有较强的还原性,放置在空气中易被氧化,其含量可通过在其弱酸性溶液中用I2溶液进行滴定。
该反应的化学方程式为:C6H8O6+I2=C6H6O6+2HI
现欲测定某样品中维生素C的含量,具体的步骤及测得的数据如下:
①取10mL6mol·L-1CH3COOH,加入100mL蒸馏水,将溶液加热煮沸后放置冷却。
②准确称取0.2000g样品,溶解于上述冷却的溶液中,并加入1mL淀粉指示剂。
③随后,立即用浓度为0.0500 mol·L-1的I2溶液进行滴定,直至溶液中的蓝色持续不褪为止,共消耗21.00mLI2溶液。
(1)为何加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用?
①煮沸的原因
②冷却后才能使用的原因
(2)经过计算,样品中维生素C的百分含量为
查看答案和解析>>
科目:高中化学 来源:2013届福建省高二下学期期末考试化学试卷(解析版) 题型:实验题
(6分,每空格2分)维生素C(又名抗坏血酸,分子式为C6H8O6)具有较强的还原性,放置在空气中易被氧化,其含量可通过在其弱酸性溶液中用I2溶液进行滴定。
该反应的化学方程式为:C6H8O6+I2=C6H6O6+2HI
现欲测定某样品中维生素C的含量,具体的步骤及测得的数据如下:
①取10mL6mol·L-1CH3COOH,加入100mL蒸馏水,将溶液加热煮沸后放置冷却。
②准确称取0.2000g样品,溶解于上述冷却的溶液中,并加入1mL淀粉指示剂。
③随后,立即用浓度为0.0500 mol·L-1的I2溶液进行滴定,直至溶液中的蓝色持续不褪为止,共消耗21.00mLI2溶液。
(1)为何加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用?
①煮沸的原因
②冷却后才能使用的原因
(2)经过计算,样品中维生素C的百分含量为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com