
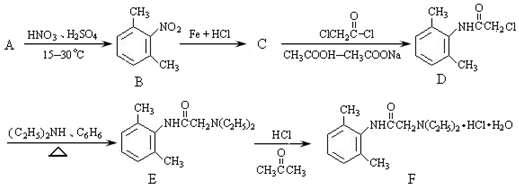
 ;
;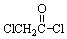 与足量的NaOH溶液共热充分反应的化学方程式:
与足量的NaOH溶液共热充分反应的化学方程式: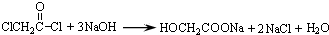 .
.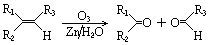
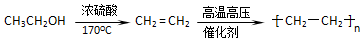
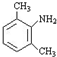
分析 由B可知A应为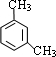 ,与浓硝酸在浓硫酸的作用下发生硝化反应生成B,B发生还原反应生成C,C为
,与浓硝酸在浓硫酸的作用下发生硝化反应生成B,B发生还原反应生成C,C为 ;以有机物CH3CH=CHCH3为原料,合成有机物CH3COOCH2CH=CHCH2OOCCH3,应首先制备CH3COOH和HOCH2CH=CHCH2OH,结合有机物的结构和性质解答该题,答题时注意把握题中转化关系判断反应特点.
;以有机物CH3CH=CHCH3为原料,合成有机物CH3COOCH2CH=CHCH2OOCCH3,应首先制备CH3COOH和HOCH2CH=CHCH2OH,结合有机物的结构和性质解答该题,答题时注意把握题中转化关系判断反应特点.
解答 解:(1)B结构对称,含有3种不同的H,对比C→D的结构简式,C为 ,生成D,变化的是-NH2→
,生成D,变化的是-NH2→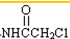 ,应为取代反应,
,应为取代反应,
故答案为:3;取代反应;
(2)由以上分析可知C为 ,故答案为:
,故答案为: ;
;
(3)B为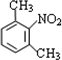 ,对应的同分异构体满足:①属于苯的衍生物,苯环上共有三个取代基;②与碳酸钠溶液反应可放出CO2气体,说明分子中含有-COOH,另外取代基为-NH2、-CH3,当-COOH、-NH2处于邻位时,-CH3有4种位置,当-COOH、-NH2处于间位时,-CH3有4种位置,当-COOH、-NH2处于对位时,-CH3有2种位置,故共有4+4+2=10种,故答案为:10;
,对应的同分异构体满足:①属于苯的衍生物,苯环上共有三个取代基;②与碳酸钠溶液反应可放出CO2气体,说明分子中含有-COOH,另外取代基为-NH2、-CH3,当-COOH、-NH2处于邻位时,-CH3有4种位置,当-COOH、-NH2处于间位时,-CH3有4种位置,当-COOH、-NH2处于对位时,-CH3有2种位置,故共有4+4+2=10种,故答案为:10;
(4)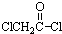 与足量的NaOH溶液共热,可生成HOCH2COONa和NaCl反应的方程式为
与足量的NaOH溶液共热,可生成HOCH2COONa和NaCl反应的方程式为 ,
,
故答案为: ;
;
(5)以有机物CH3CH=CHCH3为原料,合成有机物CH3COOCH2CH=CHCH2OOCCH3,应首先制备CH3COOH和HOCH2CH=CHCH2OH,
CH3COOH可由氧化CH3CH=CHCH3生成;HOCH2CH=CHCH2OH可由CH3CH=CHCH3与溴发生加成反应生成CH3CHBr-CHBrCH3,CH3CHBr-CHBrCH3发生消去反应生成CH2=CH-CH=CH2,CH2=CH-CH=CH2与溴发生1,4加成生成CH2BrCH=CHCH2Br,CH2BrCH=CHCH2Br水解可生成HOCH2CH=CHCH2OH,
则反应流程为 ,
,
故答案为: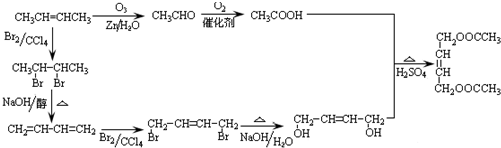 .
.
点评 本题考查有机物的合成,为高频考点和常见题型,侧重于学生的分析能力的考查,题目难度中等,本题涉及有机物的结构不是太复杂,答题中关键是要把握有机物的官能团的结构和性质,结合反应的转化特点进行判断.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 白色沉淀是CuI2,棕色溶液含有I2 | |
| B. | 滴加KI溶液时,转移1mol电子时生成1mol白色沉淀 | |
| C. | 通入SO2时,SO2与I2反应,I2作还原剂 | |
| D. | 上述实验条件下,物质的氧化性:I2>Cu2+>SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
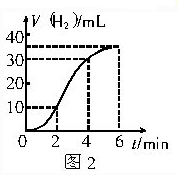
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含大量OH-的溶液:Ba2+、K+、NO3-、AlO2- | |
| B. | 加人Na2O2粉末的溶液:Na+、Cl-、SO32-、OH- | |
| C. | c(KNO3)=1.0mol/L的溶液:H+、I-、Cl-、Ca2+ | |
| D. | 滴入紫色石蕊试液呈蓝色的溶液:Fe3+、Ba2+、HCO3-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
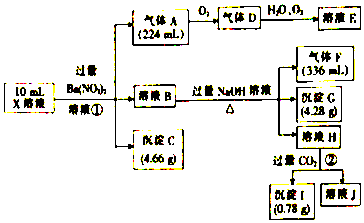
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
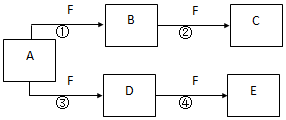 X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,D的钠盐是一种致癌物质,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.回答下列问题:
X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,D的钠盐是一种致癌物质,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.回答下列问题: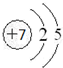 ,A的电子式为
,A的电子式为 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢元素是还原剂 | B. | O2是氧化剂 | C. | H2发生氧化反应 | D. | O2被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D>C>B>A | B. | B>C>D>A | C. | D>B>C>A | D. | C>D>A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
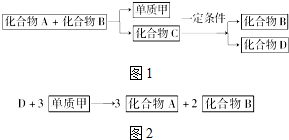 A、B、C是大家熟悉的与生命活动密切相关的三种化合物,它们所含元素不超过三种,并有如图1所示的转化关系:
A、B、C是大家熟悉的与生命活动密切相关的三种化合物,它们所含元素不超过三种,并有如图1所示的转化关系:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com