
| A、25℃时,纯重水pD=7 |
| B、25℃时,0.1mol/L NaCl的重水溶液pD=pOD=6 |
| C、25℃时,1mol/L的DCl的重水溶液pD=0,pOD=14 |
| D、25℃时,0.01mol/L NaOD的重水溶液中pD=12 |
| 10-12 |
| 0.01 |


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
| A、1molO2所占体积约为22.4L |
| B、22gCO2中含有的原子数约为6.02×1023 |
| C、100mL0.5mol/LKCl溶液中含溶质的质量为0.05g |
| D、标准状况下,11.2LN2和H2的混合气体所含分子数约为3.01×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、16O2与18O2互为同位素,H2O、D2O、T2O互为同素异形体,N60和N2互为同系物 |
| B、除稀有气体外的非金属元素都能生成不同价态的含氧酸 |
| C、非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价 |
D、Ca的原子结构示意图为 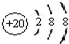 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学不做实验,就什么都不知道 |
| B、化学不再需要实验 |
| C、化学不再是纯实验科学 |
| D、未化学的方向是经验化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
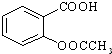 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水 S杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水 S杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下: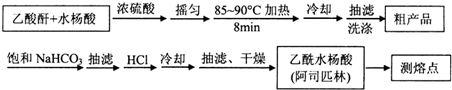
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 反应 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
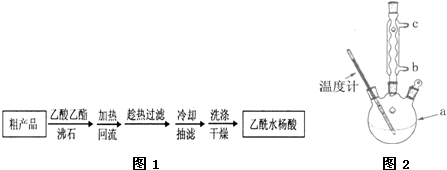
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④ | B、②③ | C、③④ | D、①② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钡原子的核外电子排布 |
| B、钡元素在周期表中的位置 |
| C、钡原子的核电荷数 |
| D、钡元素的相对原子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解精炼铜时,同一时间内阳极溶解铜的质量与阴极析出铜的质量相等 |
| B、合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| C、过程的自发性不仅能用于判断过程的方向,还能确定过程是否一定能发生 |
| D、S(g)+O2(g)=SO2(g)△H1,S(s)+O2(g)=SO2(g)△H2;则△H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓H2SO4 |
| △ |
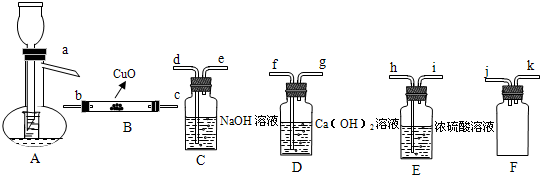
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com