
关于食物的酸碱性,下列说法中正确的是 ( )
A、食物溶于水后的溶液中PH<7,则为成酸性食物
B、由碳、氮、硫、磷等元素组成的 蛋白质多是酸性食物;蔬菜、水果多是碱性食物
蛋白质多是酸性食物;蔬菜、水果多是碱性食物
C、大米是碱性食物
D、柠檬是酸性食物
科目:高中化学 来源:2017届河北省高三上第五次调研化学卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A. 1 L2mol/LK2S溶液中S2-和HS-的总数为2NA
B.电解精炼铜时,若阴极得电子数为2NA个,则阳极质量减少64g
C. 1 mol 聚苯乙烯分子有碳碳双键的数目为NA
D. 1molMg 在空气中燃烧生成MgO(含少量Mg3N2)失去电子数为2NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二12月模拟二化学卷(解析版) 题型:选择题
下列叙述正确的是
A.漂白粉在空气中不稳定,可利用其不稳定性用于漂白纸张
B.Mg在空气中燃烧时发出耀眼的白光,可用于制造信号弹
C.氧化钠能与H2O、CO2反应,可用作漂白剂和供氧剂
D.常温时浓硝酸与铁不反应,可用铁桶贮存浓硝酸
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二12月模拟二化学卷(解析版) 题型:选择题
“垃圾是放错了位置的资源”,应分类回收利用。生活中废弃的塑料制品、旧轮胎、废纸等属于
A.单质 B.有机物 C.氧化物 D.无机物
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林长春外国语学校高二上期末化学卷(解析版) 题型:选择题
关于葡萄糖的叙述中正确的是 ( )
A.它是果糖的同系物 B.葡萄糖水解为乙醇和二氧化碳
C.葡萄糖只有还原性没有氧化性 D.葡萄糖在人体内发生氧化反应,释放能量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林长春外国语学校高二上期末化学卷(解析版) 题型:选择题
下列各组金属均有导线相连,并插入对应的液体中,其中不能组成原电池的是( )
A.Zn ∣H2SO4(稀)∣ C B.Cu ∣ AgNO3(aq)∣ Ag
C. Zn ∣ CCl4 ∣ Cu D.Fe ∣ H2SO4(稀) ∣ Cu
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省邢台市高二上学期第四次月考化学卷(解析版) 题型:推断题
夜幕降临,北京奥运会主会场“鸟巢”内灯火辉煌、鼓瑟齐鸣。璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应。鸟巢夜景照明由五个部分组成,其中主体照明以传统文化元素“中国红”为主色。请回答下列问题:
(1)火焰利用了部分金属元素特征的________反应,该反应属于_________(填“物理”或“化学”)变化。
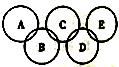
(2)如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含的电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为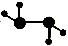 ,C可作光导纤维的主要材料,D中所含两种元素的原子个数比为3∶4,两元素的原子序数之比为2∶1。
,C可作光导纤维的主要材料,D中所含两种元素的原子个数比为3∶4,两元素的原子序数之比为2∶1。
①B的水溶液呈弱酸性,其主要的电离方程式可表示为________________,D的化学式是_____________。
②A、B、E中均含有的一种元素为____________(填元素名称)。
③E的电子式为______________。
④NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl。试写出E与足量盐酸发生反应的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省邢台市高二上学期第四次月考化学卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中能大量共存的是
A.使酚酞变红色的溶液中:Na+、A13+、SO42-、Cl-
B.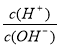 =10的溶液中:NH4+、Ca2+、 Cl-、NO3-
=10的溶液中:NH4+、Ca2+、 Cl-、NO3-
C.在氯水中:Fe2+、K+、NO3-、SO42-
D.水电离出的c(H+)=1×10-13 mol•L-1的溶液中:K+、Na+、AlO2-、HCO3-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省肇庆市高二上学期期末化学试卷(解析版) 题型:填空题
Ⅰ.CO2和CH4是两种重要的温室气体,通过CH4和CO2的反应,制造更高价值的化学品是目前的研究目标。250℃时,以镍合金为催化剂,发生如下反应:CO2(g)+CH4(g)?2CO (g)+2H2(g)
(g)+2H2(g)
(1)此温度下该反应的平衡常数表达式K= 。
(2)已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(g) △H=﹣890.3kJ•mol﹣1
② CO(g)+H2O(g)═CO2(g)+H2(g) △H=+2.8kJ•mol﹣1
③2CO(g)+O2(g)═2CO2(g) △H=﹣566.0kJ•mol﹣1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g)的△H= kJ•mol﹣1;
2CO(g)+2H2(g)的△H= kJ•mol﹣1;
(3)利用上述反应①设计燃料电池(电解质溶液为氢氧化钾溶液),写出电池负极的电极反应式 。
Ⅱ.能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上合成甲醇的反应原理为:CO(g)+2H2(g)?CH3OH(g) △H。
下表所列数据是该反应在不同温度下的化学平衡常数(K):
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
(1)根据表中数据可判断△H 0 (填“>”、“=”或“<”).
(2)300℃时,将2molCO、3molH2和2molCH3OH充入容积为1L的密闭容器中,此时反应将 (填序号):A正向移动 B逆向移动 C处于平衡状态 D无法判断
(3)下列能说明上述反应达到化学平衡状态的标志是
A.恒温恒容下,混合气体的密度不在变化
B.达平衡时,v(CO):v(H2):v(CH3OH)=1:2:1
C.达平衡时,CH3OH浓度不再变化
D.单位时间内生产nmolCO同时生成2nmolH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com