
【题目】下列指定反应的离子方程式书写不正确的是
A. 用铜电极电解MgCl2溶液:Mg2++2Cl-+2H2O![]() Mg(OH)2↓+Cl2↑+H2↑
Mg(OH)2↓+Cl2↑+H2↑
B. 饱和碳酸钠溶液中通入足量的二氧化碳:2Na++CO32-+CO2+H2O=2NaHCO3↓
C. 向Ba(OH)2溶液中加入NaHSO4至溶液为中性:Ba2++2OH-+2H++![]()
![]() BaSO4↓+2H2O
BaSO4↓+2H2O
D. 酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
【答案】A
【解析】
A.由于Cu是活泼性电极,所以Cu会参与氧化还原反应,阳极Cu失去电子,生成Cu2+,电极方程式为:Cu-2e-=Cu2+,阴极电极方程式为:2H2O+2e-=H2 ↑+2OH-,故A错误;
B.Na2CO3+CO2+H2O=2NaHCO3↓,由于NaHCO3的溶解度比碳酸钠小,所以会形成晶体析出,故B正确;
C. 向Ba(OH)2溶液中加入NaHSO4至溶液为中性,说明OH-和H+的物质的量相等,故C正确;
D. 酸性介质中KMnO4氧化H2O2的离子反应为2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O,遵循电子、电荷守恒,故D正确。
故选A。


科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据下图所示,回答下列问题:
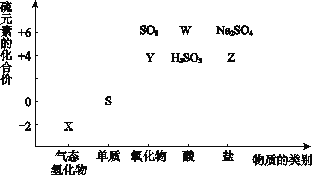
(1)Y的化学式为_________,检验Y所用的试剂是________________。
(2)W的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为__________________。
(3)欲制备Na2S2O3,从氧化还原角度分析,合理的是_______(填序号)。
a.Na2S + S b.Na2SO3 + S c.Na2SO3 + Na2SO4d.SO2 + Na2SO4
(4)将X与SO2混合,可生成淡黄色固体。该反应的氧化剂与还原剂的物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,圆底烧瓶中盛有 0.18g 镁条,加入 10.00mL2.00mol/L 的硫酸溶液 反应完全后,产生氢气 180mL。
(1)根据实验数据计算,气体的摩尔体积为_____。
(2)反应过程中,装置内空气没有排除,空气的体积对实验结果____(填“有”或“无”)影响,请简述理由:________
(3)有同学认为:若镁条中混有杂质,则实验结果会偏低。请列举实例分析该同学的观点是否正确?____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊烯是生产精细化工产品的重要中间体,其制备涉及的反应如下:
氢化反应: ,
,![]()
副反应: ,
,![]()
解聚反应: ,
,![]()
回答下列问题:
(1)反应![]() 的△H= _____ kJ/mol。
的△H= _____ kJ/mol。
(2)一定条件下,将环戊二烯溶于有机溶剂进行氢化反应(不考虑二聚反应),反应过程中保持氢气压力不变,测得环戊烯和环戊烷的产率(以环戊二烯为原料计)随时间变化如图所示:

①0~4h氢化反应速率比副反应快的可能原因是_________。
②最佳的反应时间为__h。若需迅速减慢甚至停止反应,可采取的措施有____(写一条即可)。
③一段时间后,环戊烯产率快速下降的原因可能是_________。
(3)解聚反应在刚性容器中进行(不考虑氢化反应和副反应)。
①其他条件不变,有利于提高双环戊二烯平衡转化率的是 ____(填标号)。
A.增大双环戊二烯的用量 B.使用催化剂 C.及时分离产物 D.适当提高温度
②实际生产中常通入水蒸气以降低双环戊二烯的温度(水蒸气不参与反应)。某温度下,通入总压为300 kPa的双环戊二烯和水蒸气,达到平衡后总压为500 kPa,双环戊二烯的转化率为80%,则p(H2O)=______kPa,平衡常数Kp=_______kPa (Kp为以分压表示的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.1 mol·Lˉ1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1 mol·Lˉ1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图,下列说法不正确的是( )

A. HX为弱酸
B. M点c(HX)—c(X-)﹥c(OH-)—c(H+)
C. 将P点和N点的溶液混合,呈酸性
D. 向N点的溶液中通入HCl至pH=7:c(Na+) ﹥c(HX)=c(Cl-) >c(X-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙苯是重要的化工原料,利用乙苯为初始原料合成高分子化合物J的流程如下图所示(部分产物及反应条件已略去):
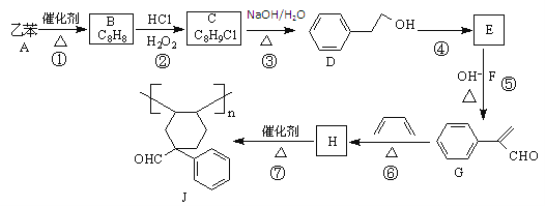
已知:①R1CHO+R2CH2CHO![]()
![]() +H2O
+H2O
②
(1)物质B的名称为________。反应④所需的试剂和条件分别为____。
(2)②、③的反应类型分别为_______。
(3)物质H中官能团的名称是_____;物质J的化学式是______。
(4)反应⑤的化学方程式为_____。
(5)写出符合下列条件,与G互为同分异构体的芳香族化合物的结构简式:_____。
ⅰ.与Na反应能够生成氢气;ⅱ.含碳碳叁键(不考虑“![]() ”结构);ⅲ.苯环上只有两个处于对位的取代基;ⅳ.核磁共振氢谱中峰的面积之比为2:2:2:1:1。
”结构);ⅲ.苯环上只有两个处于对位的取代基;ⅳ.核磁共振氢谱中峰的面积之比为2:2:2:1:1。
(6)参照上述合成路线和信息,设计由![]() 、乙醛、苯甲醇合成
、乙醛、苯甲醇合成 的路线_______(无机试剂任选)。
的路线_______(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 298 K时,2H2S(g)+SO2(g)===3S(s)+2H2O(l)能自发进行,则其ΔH>0
B. 氨水稀释后,溶液中c(NH4+)/c(NH3·H2O)的值减小
C. 电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等
D. 25℃时Ka(HClO)=3.0×108,Ka(HCN)=4.9×1010,若该温度下NaClO溶液与NaCN溶液的pH相同,则c(NaClO)>c(NaCN)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种位于不同主族的短周期元素X、Y、Z、W的原子序数依次增大,![]() 的内层电子与最外层电子数之比为2:5,Z和W位于同一周期。Z与W组成的化合物是常用的调味品,也是重要的医用药剂,工业上电解该化合物的熔融物可制得Z单质,Y和Z可形成两种离子化合物,这两种离子化合物的阴离子与阳离子数之比均为1:2。下列说法正确的是
的内层电子与最外层电子数之比为2:5,Z和W位于同一周期。Z与W组成的化合物是常用的调味品,也是重要的医用药剂,工业上电解该化合物的熔融物可制得Z单质,Y和Z可形成两种离子化合物,这两种离子化合物的阴离子与阳离子数之比均为1:2。下列说法正确的是
A. 四种元素中至少有两种金属元素
B. 四种元素的常见氢化物中熔点最高的是![]() 的氢化物
的氢化物
C. 四种元素形成的简单高子中,离子半径最小的是元素![]() 形成的离子
形成的离子
D. 常温下,![]() 三种元素形成的化合物的水溶液的
三种元素形成的化合物的水溶液的![]() 小于7
小于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 100g 46%的乙醇溶液中,含H-O键的数目为7NA
B. pH=1的H3PO4溶液中,含有0.1NA个H+
C. 0.1mol Fe在足量氧气中燃烧,转移电子数为0.3NA
D. 1L 0.1mol·L-1的NH4Cl溶液中含有NH4+数目为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com