
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,需要提纯后才能综合利用,粗盐精制的实验流程如下。
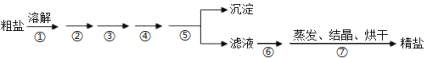
(1)下列说法不正确的是(__________)
A.在第①步中使用玻璃棒搅拌可加速粗盐溶解
B.第⑤步操作是过滤
C.在第②③④⑥步通过加入化学试剂除杂,加入试剂顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→稀盐酸
D.除去MgCl2的离子方程式为:Mg2++2OH=Mg(OH)2↓
(2)判断SO42-已除尽的方法是___。
(3)电解精制NaCl溶液可得到NaOH、Cl2和H2,它们是重要的化工原料。有关反应关系如图所示:(部分反应条件和物质省略)
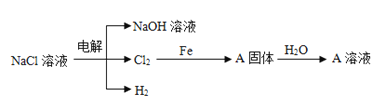
①Cl2与NaOH溶液反应可以制取“84”消毒液,发生反应的离子方程式为:__。
②写出Cl2和铁反应化学方程式,并用双线桥标出电子转移的方向和数目:__,标准状况下,22.4LCl2与足量的Fe反应,则反应过程中转移__个电子。
(4)向足量A溶液中加入少量的钠完全反应前后A溶液质量变化__(填“增大”或“减小”)。
【答案】C 在滴加BaCl2溶液的过程中,静置,取上层清液于试管中,先加盐酸至无明显现象,再加入几滴BaCl2,若无沉淀生成,则证明SO42ˉ已除尽 Cl2+2NaOH=NaCl+NaClO+H2O 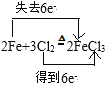 2NA 减小
2NA 减小
【解析】
(1)粗盐溶解后,镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,两种离子先除去谁都可;钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,经过蒸发、结晶、烘干,最后得到精盐,进行分析;
(2)滤液中检验硫酸离子是否存在;
(3)①氯气与氢氧化钠溶液反应生成次氯酸钠;
②铁和氯气反应生成氯化铁,根据氧化还原反应得失电子守恒,用双线桥表示该反应方程式,计算转移电子数目;
(4)钠与溶液中的水反应后生成的物质在于溶液中的溶质反应。
(1)A.第①步中用玻璃棒搅拌,加速了液体的流动,使固体很快溶解,故A正确;
B.第⑤步操作是为了将沉淀与滤液分离,所以采用过滤操作,故B正确;
C.镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,两种离子先除去谁都可;钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以正确的顺序为:![]() 或
或![]() ,Na2CO3要在BaCl2的后面加,故C错误;
,Na2CO3要在BaCl2的后面加,故C错误;
D.除去镁离子用氢氧根离子沉淀,所以离子方程式为:Mg2++2OH=Mg(OH)2↓,故D正确;
答案选C;
(2)判断杂质是否除尽,可用干净的试管取上层清液,向试管中滴加BaCl2溶液,若无沉淀说明SO42ˉ已除尽,操作方法为在滴加BaCl2溶液的过程中,静置,取上层清液于试管中,先加盐酸至无明显现象,再加入几滴BaCl2,若无沉淀生成,则证明SO42ˉ已除尽;
(3)①氯气与氢氧化钠溶液反应生成次氯酸钠、氯化钠和水,反应方程式为:Cl2+2NaOH=NaCl+NaClO+H2O;
②铁和氯气反应生成氯化铁,利用双线桥表示为: ;标准状况下22.4L Cl2的物质的量为
;标准状况下22.4L Cl2的物质的量为![]() =1mol,与铁反应时,氯元素从0价降低为-1价,所以,转移电子的物质的量为1mol×2=2mol,则转移电子数目为2NA;
=1mol,与铁反应时,氯元素从0价降低为-1价,所以,转移电子的物质的量为1mol×2=2mol,则转移电子数目为2NA;
(4)铁和氯气反应生成氯化铁,固体A为氯化铁,加水后形成的溶液为氯化铁溶液,加入钠后,钠先与水反应生成氢氧化钠,氢氧化钠在于氯化铁反应生成氢氧化铁沉淀和氯化钠,溶液的质量减小。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】2019年12月4日“全球碳计划”发布报告说,全球CO2排放量增速趋缓。人们还需要更有力的政策来逐步淘汰化石燃料的使用。CO2的综合利用是解决温室问题的有效途径。
(1)一种途径是用CO2转化为成为有机物实现碳循环。如:
C2H4(g)+H2O(l)C2H5OH(l) ΔH=-44.2kJ·mol-1;
2CO2(g)+2H2O(l)C2H4(g)+3O2(g) ΔH=+1411.0kJ·mol-1。
已知2CO2(g)+3H2O(l)C2H5OH(l)+3O2(g),其正反应的活化能为Ea kJ·mol1,则逆反应的活化能为__kJ·mol-1。乙烯与HCl加成生成的氯乙烷在碱性条件下水解也得到乙醇,其水解反应的离子方程式为__,v=kcm(CH3CH2Cl)cn(OH-)为速率方程,研究表明,CH3CH2Cl浓度减半,反应速率减半,而OH-浓度减半对反应速率没有影响,则反应速率方程式为__。
(2)利用工业废气中的CO2可以制取甲醇和水蒸气,一定条件下,往2L恒容密闭容器中充入1mol CO2和3mol H2,在三种不同催化剂作用下发生反应,相同时间内CO2的转化率随温度变化曲线如图所示:
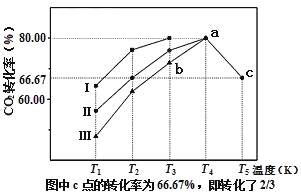
①催化剂效果最佳的反应是__(填“曲线I”,“曲线II”,“曲线III”)。
②b点,υ(正)__υ(逆)(填“>”,“<”,“=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是__。
④c点时该反应的平衡常数K=__。
(3)中国科学家首次用CO2高效合成乙酸,其反应路径如图所示:
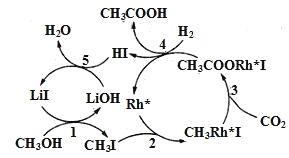
①根据图示,写出总反应的化学方程式:__。
②原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为有关分子在催化剂作用下发生转化的示意图,下列叙述正确的是( )。
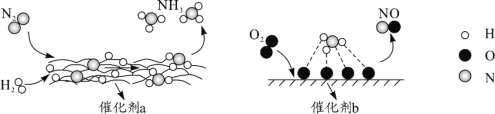
A.N2→NH3,NH3→NO均属于氮的固定
B.催化剂a作用下氮原子发生了氧化反应
C.催化剂a、b表面均发生了极性共价键的断裂
D.使用催化剂a、b均可以提高单位时间内生成物的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备相关物质,涉及的反应原理及部分流程较为合理的是
A.制取镁:海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO ![]() Mg
Mg
B.冶炼铝:铝土矿![]() NaAlO2
NaAlO2 ![]() 无水 AlCl3
无水 AlCl3![]() Al
Al
C.制硝酸: N2、H2![]() NH3
NH3![]() NO
NO![]() 50%HNO3
50%HNO3![]() 浓 HNO3
浓 HNO3
D.海带![]() 海带灰
海带灰![]() I2(aq)
I2(aq) ![]() I2
I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,对该物质的说法正确的是

A. 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B. 滴入酸性KMnO4溶液,观察紫色褪去,能证明结构中存在碳碳双键
C. 1 mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别为6 mol、7 mol
D. 该分子中的所有碳原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 R、T、Q、W 在元素周期表中的相对位置如图所示,其中 T 所处的周期序数与族序数相等下列判断不正确的是

A.最简单气态氢化物的热稳定性:R >Q
B.最高价氧化物对应水化物的酸性:Q< W
C.R 的氧化物是酸性氧化物
D.含 T 的盐溶液可能显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.32 g纯Fe溶于足量稀H2SO4中,在加热条件下用2.53 g KNO3去氧化溶液中的Fe2+,充分反应后余下的Fe2+还原0.009 mol Cl2才能完全氧化,则KNO3的还原产物中N的化合价是
A.–3B.+4C.+3D.+2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅是一种高温陶瓷材料,它硬度大、熔点高,化学性质稳定,工业上普遍采用高纯硅与纯氮在1 300 ℃反应获得。
(1)根据性质,推测氮化硅陶瓷的用途是________。(填序号)
A.制汽轮机 | B.制有色玻璃 |
C.制永久性模具 | D.制造柴油机 |
(2)写出N的原子结构示意图__________,根据元素周期律知识,请写出氮化硅的化学式_________________。
(3)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应,试推测该陶瓷被氢氟酸腐蚀的化学方程式___________________________________。
(4)现用四氯化硅与氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅,反应的化学方程式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁发给来自美国、英国、日本的三位科学家,表彰他们在锂离子电池方面的研究贡献。锂离子电池广泛应用要求处理锂电池废料以节约资源、保护环境。锂离子二次电池正极铝钴膜中主要含有钴酸锂(LiCoO2)、Al等,处理该废料的一种工艺如下图所示:

回答下列问题:
(1)铝钴膜在处理前初步进行粉碎的目的是________________________。
(2)能够提高“碱浸”效率的方法有________________________(至少写两种)。
(3)“碱浸”时Al溶解的离子方程式为________________________。
(4)“酸溶”时加入H2O2的目的是________________________。
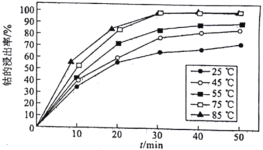
(5)溶液温度和浸渍时间对钴的浸出率影响如图所示,则浸出过程的最佳条件是_______________________。
(6)配制250 mL 1.0 mol/L (NH4)2C2O4溶液,需要的玻璃仪器除玻璃棒、烧杯外还需要________。
(7)取CoC2O4固体4.41g在空气中加热至300℃,得到钴的氧化物2.41g,则该钴的氧化物的化学式为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com