
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的( )
①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液.
|
| A. | ②④⑥ | B. | ①② | C. | ②③⑤ | D. | ②④⑤⑥ |
考点:
化学反应速率的影响因素.
专题:
化学反应速率专题.
分析:
Fe与盐酸反应的实质为Fe+2H+═Fe2++H2↑,为了减缓反应速度,且不影响生成氢气的总量,则可减小氢离子的浓度,但不改变氢离子的物质的量,以此来解答.
解答:
解:Fe与盐酸反应的实质为Fe+2H+═Fe2++H2↑,为了减缓反应速度,且不影响生成氢气的总量,则可减小氢离子的浓度,但不改变氢离子的物质的量,
①加入NaOH固体,氢离子的物质的量及浓度均减小,故①错误;
②加入H2O,减小氢离子的浓度,但不改变氢离子的物质的量,故②正确;
③加入NH4Cl固体,氢离子的浓度、氢离子的物质的量都没有变化,故③错误;
④加入CH3COONa固体与盐酸反应生成弱酸,减小氢离子的浓度,但不改变氢离子的物质的量,故④正确;
⑤加入NaNO3固体,氢离子的浓度、氢离子的物质的量都没有变化,故⑤错误;
⑥加入KCl溶液,减小氢离子的浓度,但不改变氢离子的物质的量,故⑥正确;
显然②④⑥正确,
故选:A.
点评:
本题考查影响化学反应速率的因素,明确反应的实质及氢离子的浓度减小是解答本题的关键,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
化学与“美丽厦门”
(1)化学让天更蓝
①汽车尾气处理中使用了催化剂,该催化剂中某元素在元素周期表中的部分内容如图1所示,从中获取一条信息: .
②公交车使用天然气等清洁能源,写出天然气主要成分燃烧的化学方程式: .
③未来氢能源汽车可实现零污染.在催化剂、光作用下,水分解获得氢能源,写出该方法获得氢能源的化学方程式: .
(2)化学让水更洁净
①生活污水截流处理过程如图2所示,其中采用的净水方法有 (写出一种).
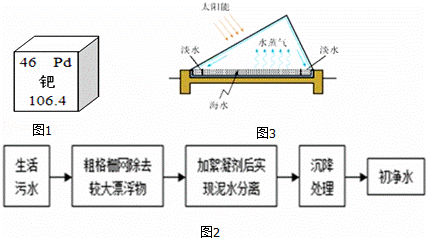
②图3是从海水中获取淡水的一种装置,请从能源角度指出其优点: .
③检验上述所获取的水是否为硬水,常用试剂是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
A是一种信息材料的添加剂,在相同条件下,A蒸气的质量是同体积氢气质量的88.25倍.在A分子中各元素质量分数分别为w(C)=54.4%,w(H)=7.4%,w(O)=18.1%,w(Cl)=20.1%,A在不同条件下可发生如图所示的一系列变化.
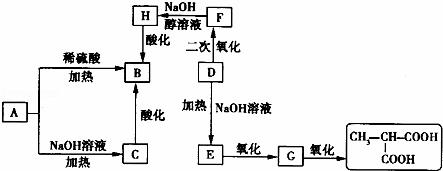
请回答下列问题:
(1)A的分子式为 .
(2)D分子含有的官能团是 .
(3)上述转换关系的化学方程式中,属于水解反应的有 个(填数字).
(4)写出化学方程式:
①A和稀硫酸共热: ;
②E氧化成G: ;
③F与氢氧化钠醇溶液共热: .
(5)与B互为同分异构体的且属于链状酯的物质共有 种.
查看答案和解析>>
科目:高中化学 来源: 题型:
FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是()
A. 加入KSCN溶液一定不变红色 B. 溶液中一定含Fe2+
C. 溶液中一定不含Cu2+ D. 剩余固体中一定含Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
反应:A+3B⇌2C+D,在四种不同情况下的反应速率分别为:
①vA=0.15mol•L﹣1min﹣1
②vB=0.6mol•L﹣1min﹣1
③vC=0.4mol•L﹣1min﹣1
④vD=0.45mol•L﹣1min﹣1
该反应进行得最快的是( )
|
| A. | ① | B. | ④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学原理的应用,主要用沉淀溶解平衡原理来解释的是( )
①热纯碱溶液的洗涤油污能力强;
②误将钡盐[BaCl2、Ba(NO3)2]当作食盐食用时,常用0.5%的Na2SO4溶液解毒;
③溶洞、珊瑚的形成;
④碳酸钡不能做“钡餐”而硫酸钡则能;
⑤泡沫灭火器灭火的原理.
|
| A. | ②③④ | B. | ①②③ | C. | ③④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,是该碱溶液的pH等于( )
|
| A. | 9.0 | B. | 9.5 | C. | 10.5 | D. | 11.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下的恒容容器中,反应A(s)+2B(g)⇌C(g)+D(g)已达平衡状态的是( )
|
| A. | 混合气体的压强不随时间变化而变化 |
|
| B. | 混合气体的密度不随时间变化而变化 |
|
| C. | 气体总物质的量不随时间变化而变 |
|
| D. | 单位时间内生成n mol C,同时消耗2n molB |
查看答案和解析>>
科目:高中化学 来源: 题型:
由铜、锌和稀硫酸组成的原电池中(图1):
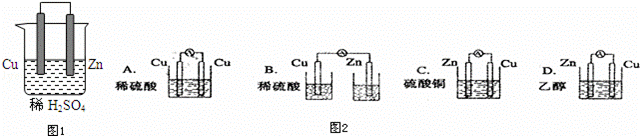
(1)锌是负极,电极反应式是 .铜是正极,电极反应式是 .总反应式
(2)在铜极上可以观察到 ,在锌极可以观察到 (填实验现象)
(3)图2装置能够组成原电池是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com