
A、HClO的电子式为: |
B、CH4分子的球棍模型: |
| C、甲酸甲酯的实验式:CH2O |
| D、2-戊烯的结构简式:CH3CH2CH=CHCH3 |
 为甲烷的比例模型,不是球棍模型;
为甲烷的比例模型,不是球棍模型; ,故A正确;
,故A正确; 为甲烷的比例模型,甲烷的球棍模型应该用小球和短棍表示,甲烷为正四面体结构,其正确的球棍模型为:
为甲烷的比例模型,甲烷的球棍模型应该用小球和短棍表示,甲烷为正四面体结构,其正确的球棍模型为: ,故B错误;
,故B错误;

 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
| A、①③⑤ | B、②④⑥ |
| C、①③④ | D、③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、②⑤ |
| C、②③⑤ | D、①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中四种粒子之间可能满足:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| B、若溶液中部分粒子间满足:c(CH3COO-)=c(Na+)则该溶液一定呈中性 |
| C、若溶液中溶质仅为CH3COONa,则粒子间一定满足:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D、若溶液中的溶质为CH3COONa和CH3COOH,则溶液中粒子间一定满足:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铝溶液中加入过量的氨水Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
| B、用氨水吸收过量的二氧化硫NH3?H2O+SO2═NH4++HSO3- |
| C、向偏铝酸钠溶液中加入过量稀盐酸水AlO2-+H++H2O═Al(OH)3↓ |
| D、次氯酸钙溶液中通入过量的二氧化碳ClO-+CO2+H2O═HCO3-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:

 .化合物
.化合物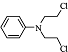 是合成抗癌药物美发伦的中间体,现以
是合成抗癌药物美发伦的中间体,现以 和
和 为原料制备该化合物的合成路线流程图如下,请在空白处填写相应的有机物的结构简式.
为原料制备该化合物的合成路线流程图如下,请在空白处填写相应的有机物的结构简式.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com