
| 实验编号 | HA的物质的量浓度(mol?L-1) | NaOH的物质的量浓度(mol?L-1) | 混合后溶 液的pH |
| 甲 | 0.1 | 0.1 | pH=7 |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
| c(标准)V(标准) |
| V(待测) |
| c(标准)V(标准) |
| V(待测) |


科目:高中化学 来源: 题型:
| 滴定 次数 | 待测溶液 的体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能与铝反应产生H2的溶液:NH4+、Na+、Cl-、HCO3- |
| B、澄清透明的溶液中:I-、Cl-、ClO-、Na+ |
| C、pH=1的溶液中:K+、Fe2+、NO3-、MnO4- |
| D、由水电离出的c(OH-)=l×10-11 mol/L的溶液中:K+、Al3+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l);△H=-1135.7 kJ/mol | ||
B、N2H4(g)+NO2(g)=
| ||
C、N2H4(g)+NO2(g)=
| ||
| D、2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=+1135.7 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、任何晶体中,若含有阳离子也一定含有阴离子 |
| B、金属键越强,则该金属的金属性越强 |
| C、将铁制品做成炊具,金属键没有被破坏 |
| D、金属导电的过程实质上就是金属键被破坏的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
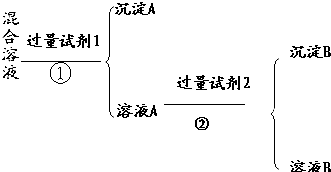
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com