解:Ⅰ.(1)装置A为碳酸钙与盐酸反应制二氧化碳,所需药品是石灰石和6mol/L盐酸,故答案为:ac;
(2)饱和NaHCO
3溶液可除掉挥发出来的氯化氢,故答案为:除去二氧化碳中的氯化氢;
(3)实验室制取氨气采用氯化铵和氢氧化钙加热制的生成氯化钙、氨气和水,方程式为:2NH
4Cl+Ca(OH)
2
CaCl
2+2NH
3↑+2H
2O,故答案为:2NH
4Cl+Ca(OH)
2
CaCl
2+2NH
3↑+2H
2O;
(4)氨气极易溶于水,易于二氧化碳的吸收,所以应先通入氨气,故答案为:NH
3;
(5)氨气是碱性气体,能使红色石蕊试纸变蓝;氨气能和浓盐酸反应生成白烟,故答案为:用湿润的红色石蕊试纸放到D出口处,如果试纸变蓝,则氨气逸出,反之则不逸出,或用玻璃棒蘸取浓盐酸靠近试管口处,若观察到白烟,则氨气则氨气逸出,反之则不逸出;
(6)氨气溶于水生成氨水,溶液呈碱性,二氧化碳是酸性气体,能和碱反应生成碳酸铵,碳酸铵和氯化钙发生复分解反应生成碳酸钙和氯化铵:CaCl
2+CO
2+2NH
3+H
2O=CaCO
3↓+2NH
4Cl,故答案为:CaCl
2+CO
2+2NH
3+H
2O=CaCO
3↓+2NH
4Cl;
(7)将少量碳酸钙加水充分搅拌,看是否有丁达尔效应,若有丁达尔效应,则说明为纳米级,故答案为:将少量碳酸钙加水充分搅拌,用一束可见光照射,观察是否发生丁达尔现象,若有丁达尔现象则为纳米级,若没有丁达尔现象则不是纳米级;
(8)氨气极易溶于水要防止倒吸,故答案为:b;
Ⅱ.根据题目信息可知:碳酸氢钠能与氢氧化钡或氢氧化钙反应生成沉淀,根据沉淀的质量求出碳酸氢钠的质量,最后求出氯化铵的质量以及质量分数;
(1)A为氢氧化钡或氢氧化钙,碳酸氢钠能与氢氧化钡或氢氧化钙反应生成沉淀来,检验所加试剂氢氧化钡或氢氧化钙已经过量的方法是向澄清液中继续滴加氢氧化钡或氢氧化钙溶液,若不产生沉淀,则氢氧化钡或氢氧化钙溶液已过量,
故答案为:Ca(OH)
2或Ba(OH)
2;向澄清液中继续滴加氢氧化钡或氢氧化钙溶液,若不产生沉淀,则氢氧化钡或氢氧化钙溶液已过量;
(2)不溶物和溶液分离用过滤的方法,碳酸钡或碳酸钙不溶于水,用水洗涤即可,
故答案为:过滤;向沉淀中继续加蒸馏水,静置流下,重复两次即可,故答案为:向沉淀中继续加蒸馏水,静置流下,重复两次即可;
(3)若试剂为Ca(OH)
2溶液,则:
NaHCO
3~Ca(OH)
2 ~CaCO
3 84 100
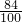
W
2 W
2所以氯化铵的质量为:W
1-
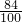
W
2,氯化铵的质量分数为:

%,
同理,若试剂为Ba(OH)
2溶液,氯化铵的质量分数为:

%,
故答案为:

%或

%.
分析:Ⅰ.(1)根据装置特点可知A为二氧化碳的发生装置,E为氨气的发生装置;
(2)装置B目的是除掉挥发出来的氯化氢;
(3)实验室制取氨气采用氯化铵和氢氧化钙加热制的生成氯化钙、氨气和水;
(4)根据二氧化碳和氨气的溶解性判断先通入的气体;
(5)根据氨气的检验方法;
(6)由反应物和生成物写出反应方程式.
(7)将少量碳酸钙加水充分搅拌,看是否有丁达尔效应;
(8)根据氨气极易溶于水要防止倒吸;
Ⅱ.根据题目信息可知:碳酸氢钠能与氢氧化钡或氢氧化钙反应生成沉淀,根据沉淀的质量求出碳酸氢钠的质量,最后求出氯化铵的质量以及质量分数;
(1)A为氢氧化钡或氢氧化钙;根据碳酸氢钠能与氢氧化钡或氢氧化钙反应生成沉淀来解答;
(2)不溶物和溶液分离用过滤的方法;根据沉淀不溶于水,用水洗涤即可;
(3)根据沉淀的质量求出碳酸氢钠的质量,最后求出氯化铵的质量以及质量分数.
点评:本题考查了氨气的实验室制法以及物质含量的测定,难度不大,掌握实验的原理是解题的关键.


 CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;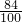 W2 W2
W2 W2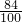 W2,氯化铵的质量分数为:
W2,氯化铵的质量分数为: %,
%, %,
%, %或
%或 %.
%.

![]() KIO3+3H2↑。阳极反应式是______________。
KIO3+3H2↑。阳极反应式是______________。