
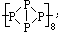 ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | 是一种极性分子易溶于水 | |
| B. | 分子中,每个磷原子以3个共价键结合3个磷原子 | |
| C. | 相对分子质量8倍于白磷分子 | |
| D. | 它和白磷都是磷的同素异形体 |
分析 A.由同种原子构成的共价键是非极性键,不同原子构成的共价键是极性键,分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,根据结构相似相溶分析其溶解性;
B.该分子中每个P与相邻的P均形成三条P-P键;
C.白磷分子的分子式为P4;
D.由同种元素形成的不同种单质互为同素异形体.
解答 解:A.该分子中的化学键均为P-P键,由非极键形成的非极性分子,难溶于极性溶剂水,故A错误;
B.根据该磷分子具有链状结构可知,该分子中每个P与相邻的P均形成三条P-P键,故B正确;
C.该磷分子具有链状结构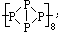 ,白磷分子的分子式为P4,该磷分子相对分子质量8倍于白磷分子,故C正确;
,白磷分子的分子式为P4,该磷分子相对分子质量8倍于白磷分子,故C正确;
D.它和白磷都是由磷元素形成的单质,互为同素异形体,故D正确;
故选A.
点评 本题考查了分子晶体的组成、化学键类型、同素异形体等知识,题目难度不大,注意白磷结构.


科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/(mol•L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500 s内NO2的生成速率为2.96×10-3 mol•L-1•s-1 | |
| B. | T1温度下该反应平衡时N2O5的转化率为29.6% | |
| C. | 达到平衡其他条件不变,将容器的体积压缩到原来1/2,则c(N2O5)<5.00mol•L-1 | |
| D. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.02mol/(L•min) | B. | v(N2)=0.02mol/(L•min) | ||
| C. | v(N2)=0.01mol/(L•min) | D. | v(H2)=0.015mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓ | |
| B. | 少量CO2气体通入苯酚钠溶液中:2  →O-+H2O+CO2→2 →O-+H2O+CO2→2  -OH+CO32- -OH+CO32- | |
| C. | 甲苯与浓硝酸和浓硫酸的混合物反应: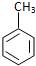 +3HNO3$→_{100℃}^{浓H_{2}SO_{4}}$ +3HNO3$→_{100℃}^{浓H_{2}SO_{4}}$ +3H2O +3H2O | |
| D. | 工业上通过苯与乙烯反应获得乙苯: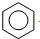 +CH2═CH2$→_{△}^{催化剂}$ +CH2═CH2$→_{△}^{催化剂}$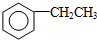 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g乙烯和聚乙烯完全燃烧生成的CO2分子数均为2NA | |
| B. | 25℃时,pH=3的1.0L NaHSO3溶液中,含Na+数目为0.001NA | |
| C. | 2.24LNH3中含共价键数目为0.3 NA | |
| D. | 78g苯含有C=C双键的数目为3 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com